
 2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.
2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.
| ||
 ,故答案为:
,故答案为: ;
;
| ||
| 1.8×103g |
| 18g/mol |
| ||
| 1L |
| 9.6×10-3g |
| 96g/mol |


科目:高中化学 来源: 题型:
| A、加入铜粉,v(H2)增大 |
| B、加入NaHSO4固体,v(H2)不变 |
| C、加入水,锌不与水反应,v(H2)不变 |
| D、加入NaCl固体,会增大Cl-浓度,使v(H2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 取代苯甲醛 | 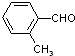 |  |  |  |
| 产率(%) | 15 | 23 | 33 | 0 |
| 取代苯甲醛 |  |  |  |  |
| 产率(%) | 71 | 63 | 52 | 82 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的质子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答:
如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的质子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数 | 一 | 二 | 三 |
| 所取黄铜样品的质量(g) | 10.0 | 10.0 | 20.0 |
| 加入稀硫酸的质量(g) | 100.0 | 80.0 | 80.0 |
| 反应后烧杯内剩余物质的质量(g) | 109.8 | 89.8 | 99.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 若在一个密闭绝热容器W中,同时进行如下两个可逆反应:
若在一个密闭绝热容器W中,同时进行如下两个可逆反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com