
【题目】把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含bmolBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的物质的量为
A. (b-a)molB. (2b-a)molC. 2(b-a)molD. 2(2b-a)mol
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】电镀废液中Cr2O7可通过下列反应转化成铬黄(PbCrO4):
Cr2O![]() (aq)+2Pb2+(aq)+H2O(l)
(aq)+2Pb2+(aq)+H2O(l) ![]() 2PbCrO4(s)+2H+(aq) ΔH<0
2PbCrO4(s)+2H+(aq) ΔH<0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是 ( )。
A. 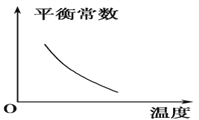 B.
B. 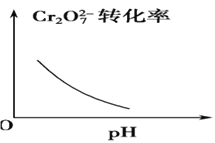
C.  D.
D. 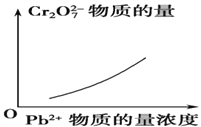
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有稀盐酸的烧杯中逐滴加入NaOH溶液,测得烧杯中溶液的pH变化如图所示,下列说法正确的是( )

A.a点所示的溶液中含有的溶质是NaOH和NaCl
B.b点所示的溶液能使紫色石蕊溶液变红
C.c点表示NaOH和稀盐酸恰好完全反应
D.a、b、c所示的溶液中都含有Na+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量转化的认识不正确的是( )
A.绿色植物的光合作用是将光能转化为化学能
B.煤燃烧时化学能转化成热能和光能
C.原电池工作时,化学能转化为电能
D.白炽灯工作时,电能全部转化为光能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2NOCl(g)。
2NOCl(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+NOCl(g)
NaNO3(s)+NOCl(g)
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)
③2NO(g)+Cl2(g)![]() 2NOCl(g)
2NOCl(g)
设反应①②③对应的平衡常数依次为K1、K2、K3,则K1、K2、K3之间的关系为______________。
(2)300 ℃时,2NOCl(g) ![]() 2NO(g)+Cl2(g)。
2NO(g)+Cl2(g)。
正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示:
序号 | c(NOCl)/mol·L-1 | v/mol·L-1·s-1 |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
③ | 0.90 | 3.24×10-8 |
n=____________,k=______________。
(3)在1 L恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:

①反应开始到10 min时NO的平均反应速率v(NO)=_________________ mol·L-1·min-1。
②T2时该反应的平衡常数K为_______________________。
③Cl2的平衡转化率为____________________________。
(4)在密闭容器中充入NO(g)和Cl2(g),改变外界条件(温度、压强、 、与催化剂的接触面积),NO的转化率变化关系如图B所示。X代表_______________________。
、与催化剂的接触面积),NO的转化率变化关系如图B所示。X代表_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式).
(2)将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为_______.
(3)检验物质Y的方法是_______________________________.
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______.
(5)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号).
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr207氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的溶液恰好反应时,Cr元素在还原产物中的化合价为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Zn+H2SO4=ZnSO4+H2↑下列措施能使产生氢气的速率加快的是
A. 将锌粉替换为锌片B. 向反应的溶液中入氯化钠溶液
C. 将锌与稀硫酸的反应温度升高D. 向反应的溶液中加入硫酸钠固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() ;
;
② 苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图:

(1)A转化为B的化学方程式是_________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________,②____________________。
(3)苯的二氯代物有__________种同分异构体。
(4)有机物 的所有原子_______(填“是”或“不是”)在同一平面上。
的所有原子_______(填“是”或“不是”)在同一平面上。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com