
| A、CO2、SO2、NH3、Na2O溶于水能导电,所以它们是电解质 |
| B、BaSO4、AgCl在水中溶解度很小,所以是弱电解质 |
| C、向醋酸溶液中加入氢氧化钠固体,溶液导电性增强 |
| D、向氨水中加水后,溶液中所有离子浓度都减小 |


科目:高中化学 来源: 题型:
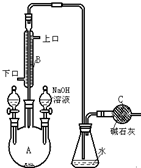 制备溴苯的实验装置如图所示,请回答下列问题:
制备溴苯的实验装置如图所示,请回答下列问题: +Br+→[
+Br+→[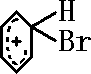 ];[
];[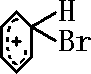 ]+FeBr4-→
]+FeBr4-→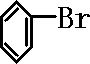 +HBr+FeBr3;
+HBr+FeBr3; +Br2→
+Br2→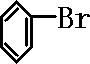 +HBr中的催化剂为
+HBr中的催化剂为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑥ | B、②③ | C、①③ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol SO2+1 mol O2 |
| B、4 mol SO2+1 mol O2 |
| C、2 mol SO2+1 mol O2+2 SO3 |
| D、3 mol SO2+0.5 mol O2+1 SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
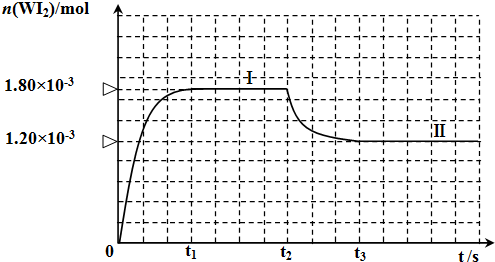
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业生产硫酸时,接触室中采用高温高压条件都能提高SO2和O2的转化率 |
| B、高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能消毒杀菌又能净水 |
| C、阴离子交换树脂可以除去硬水中的Ca2+、Mg2+ |
| D、工业上电解熔融AlCl3可制金属铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com