
| A. | 碳酸钙溶于醋酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 澄清石灰水中加入盐酸Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片加入稀硝酸中3Cu+2NO3-+8H+═3Cu2++2N0↑+4H20 | |
| D. | 小苏打溶液和盐酸混合CO32-+2H+═CO2↑+H2O |
分析 A.醋酸在离子反应中保留化学式;
B.反应生成氯化钙和水,石灰水完全电离;
C.反应生成硝酸铜、NO和水;
D.小苏打为碳酸氢钠.
解答 解:A.碳酸钙溶于醋酸的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O,故A错误;
B.澄清石灰水中加入盐酸的离子反应为OH-+H+═H2O,故B错误;
C.铜片加入稀硝酸中的离子反应为3Cu+2NO3-+8H+═3Cu2++2N0↑+4H20,故C正确;
D.小苏打溶液和盐酸混合的离子反应为HCO3-+H+═CO2↑+H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:解答题
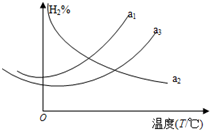 利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:| 反应时间t/min | 20 | 40 | 60 | 80 |
| c(CO2)(mol/L) | 0.300 | 0.180 | 0.109 | 0.066 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
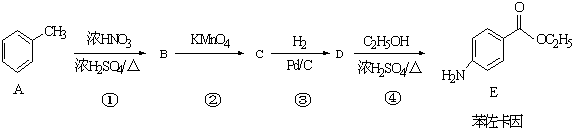
 .
.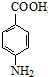 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$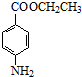 +H2O
+H2O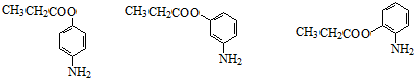 (其中一种)(任写一种)
(其中一种)(任写一种) )的合成路线图(其他原料任选).
)的合成路线图(其他原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
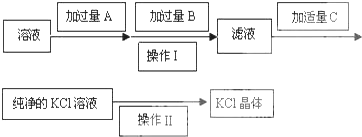
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
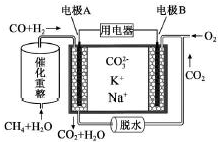
| A. | 正极产物为CO2 | |
| B. | 负极电极反应式为CO-2e-+CO32-═2CO2 | |
| C. | 电池工作时,CO32-向电极A移动 | |
| D. | 电池总反应式为CO+H2+O2═2CO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
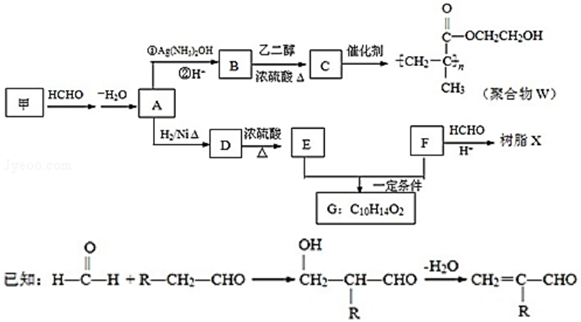
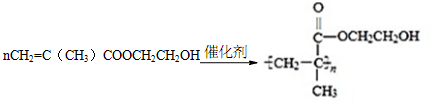 .
.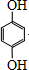
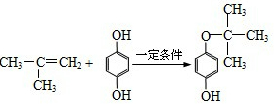 ,反应类型是加成反应.
,反应类型是加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O>Na2O2 | B. | Na2CO3>NaHCO3>H2CO3 | ||
| C. | Na2SO4•10H2O>Na2CO3•10H2O | D. | NaClO>NaCl>NaF |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com