
【题目】下列说法中,正确的一项是( )
A.因为Cu可以导电,所以Cu是电解质
B.因为NaHSO4可以电离出H+ , 所以属于酸
C.武德合金熔点低(70℃),可以做保险丝
D.造成酸雨的主要大气污染物是SO2和CO2
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA溶液,溶液pH的变化曲线如图所下列说法不正确的是
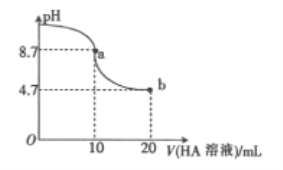
A. a点所示溶液中:c(A-)>c(Na+)>c(OH-)>c(H+)
B. a点所示溶液中:c(Na+)=0.05mol/L
C. pH=7时,c(Na+)=c(A-)
D. b点所示溶液中:c(Na+)<c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于某物质是否为电解质的判断正确的是( )
A.固体氯化钠不导电,所以氯化钠不是电解质
B.氯化氢水溶液能导电,所以氯化氢是电解质
C.SO2溶于水能导电,所以SO2是电解质
D.氨水能导电,所以氨水是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应2A(g)+3B(g) ![]() 4C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
4C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A. v(A)=0.9 mol·L-1·min-1 B. v(B)=1.5 mol·L-1·min-1
C. v(D)=0.8 mol·L-1·min-1 D. v(C)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】锰及其化合物用途非常广泛。回答下列问题:
(1)Al70Pd21Mn9是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法是___________。
(2)基态Mn原子的价电子排布式为_________,未成对电子数为_____个。
(3)MnS熔点(1610℃)比MnO熔点(1650℃)低,其原因是____________。
(4)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为________。
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是_____,该分子中碳原子的杂化方式为_______;C、H、N的电负性从大到小的顺序为________。
(5)锰的含氧酸有HMnO4(高锰酸)、H2MnO3(亚锰酸),高锰酸的酸性比亚锰酸强,理由是_________。
(6)某种含锰特殊材料的晶胞结构如下图所示:
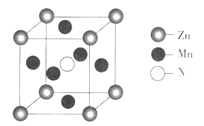
若晶胞参数为anm,用NA表示阿伏加德罗常数的值,则该晶胞的密度为____(列出代数式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D的原子序数依次增大。甲、乙、丙、丁、戊是由这些元素组成的常见化合物,其中丙、丁、戊为二元化合物,已是元素C的单质。甲、乙的溶液均呈碱性。下列说法错误的是
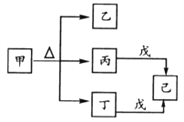
A. 甲和戊加入水中都能破坏水的电离平衡 B. 乙和戊都含有离子键
C. 原子半径r(D)>r(B)>r(C)>r(A) D. A、B、C形成的化合物一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Mg2+、NH4+、Al3+、Fe3+、CO32—、SO42—中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
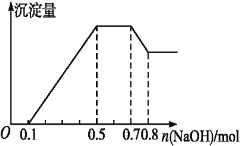
A. 溶液中的阳离子有H+、Mg2+、NH4+、Al3+
B. 溶液中n(Al3+)=0.1 mol
C. 溶液中一定不含CO32—,可能含有SO42—
D. n(H+)∶n(Al3+)∶n(Mg2+)=2∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组实验探究葡萄糖、二氧化硫分别与新制氢氧化铜的反应。
实验I新制Cu(OH)2与葡萄糖反应
(1)将1.5mL1.0mol/LCuSO4溶液滴入5mLl.0mol/LNaOH溶液中制得Cu(OH)2悬浊液。相关反应的离子方程式为___________。
(2)在制得的Cu(OH)2悬浊液中加入稍过量葡萄糖溶液,加热煮沸,产生红色沉淀。
①该实验现象说明_______________;
②该原理可用于检测糖尿病患者血液中的______含量。
实验II新制Cu(OH)2与二氧化硫反应
按上述方法重新制取氢氧化铜悬浊液,通入足量二氧化硫,先产生红色沉淀,然后红色沉淀逐渐变为紫红色固体,最终溶液呈无色。
(1)探究红色沉淀转变为紫红色的原因。
将实验I产生的红色沉淀过滤、洗涤,洗涤方法是_____。
将所得固体分成两等份于试管中并加入少量蒸馏水进行对比实验。
实验装置图 |
|
|
操作及现象 | 红色固体很快转变为紫红色固体,溶液呈蓝色。 | 开始红色固体缓慢变为紫红色固体,溶液呈蓝色。试管内紫红色固体逐渐增多,最后溶液变无色。 |
解释及结论 | ①该反应的离子方程式 _________________。 | ②开始时红色固体颜色变化缓慢的原因是_________。 ③所得无色溶液中主要阴离子为___________________。 |
(2)通过上述探究,写出新制氢氧化铜与过量SO2反应的总化学方程式______________。
反思:将表中SO2换为NO2是否能观察到相同现象?回答并解释:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将定量的Na2CO3和NaHCO3的混合物加热到不再放出气体时,收集到CO2aL,冷却后向残余物中加入足量盐酸又收集到CO2 2 aL (体积均在标准状况下测定)。则混合物中Na2CO3和NaHCO3的物质的量之比为( )
A. 1:1 B. 1:2 C. 1:3 D. 1:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com