
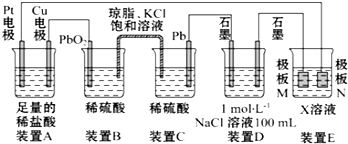
分析 (1)B和C装置形成原电池,铅作负极,二氧化铅作正极,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅;
(2)电镀时,镀层作阳极,镀件作阴极,电解质溶液中阳离子和镀层金属相同;
(3)根据转移电子守恒计算生成气体的体积;
(4)根据信息:该电解池(电极为惰性材料)电解除去NH3,净化污水;该净化过程分两步:第一步电解产生氧化剂,即产生能将氨氧化为氮气的物质,第二步氧化剂氧化氨氮物质生成N2,据电解池的工作原理结合发生的反应来回答.
解答 解:(1)B和C装置形成原电池,铅作负极,二氧化铅作正极,原电池放电时,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅,发生还原反应,C装置中Pb上的电极反应式为:Pb-2e-+SO42-═PbSO4,
故答案为:Pb-2e-+SO42-═PbSO4;
(2)电镀时,镀层作阳极,镀件作阴极,电解质溶液中阳离子和镀层金属相同,若装置D的目的是在某镀件上镀银,则X为硝酸银溶液,N作阳极,应该是银,若装置E的目的是验证金属的电化学防腐,则极板N的材料为惰性电极(或石墨等不溶性惰性材料),被保护的金属连接电源阴极,
故答案为:Ag;AgNO3;
(3)当装置A中Cu电极质量改变0.32g时,n(Cu)=$\frac{0.32g}{64g/mol}$=0.005mol,则转移了0.01mol电子,装置D中n(NaCl)=1mol/L×0.1L=0.1mol,阳极发生2Cl-2e-=Cl2↑,阴极发生2H++2e-=H2↑,消耗了0.01mol氢离子,则溶液中产生0.01mol氢氧根离子,氢氧根离子浓度为:$\frac{0.01mol}{0.1L}$=0.1mmol/L,该溶液的pH=13,
故答案为:13;
(4)①根据图示知道:N电极是电解池的阳极,该电极上发生失电子的氧化反应,可以得到氧化剂,根据离子的放电顺序,即氯离子失电子产生氯气的过程,电极反应式为:2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;
②第二步氧化剂氯气氧化氨氮物质即氨气生成N2的过程,发生的反应为:3Cl2+2NH3=N2+6HCl或3Cl2+8NH3=N2+6NH4Cl,
故答案为:3Cl2+2NH3=N2+6HCl或3Cl2+8NH3=N2+6NH4Cl.
点评 本题考查了原电池、电解池的工作原理,题目难度中等,根据图示正确判断原电池、电解池为解答关键,注意掌握原电池、电解池工作原理,试题培养了学生的灵活应用能力.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述不正确的是( )
如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述不正确的是( )| A. | t2时,反应到达限度 | B. | t2-t3,反应仍在进行 | ||
| C. | t1时,只有正方向反应 | D. | t2-t3,各物质的浓度不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2═O2+2NO;△H=+116.2kJ/mol(反应热) | |
| B. | S(s)+O2(g)═SO2(g);△H=+269.8kJ/mol(反应热) | |
| C. | Ba(OH)2(aq)+2HCl(aq)═BaCl2(aq)+2H2O(l));△H=-57.3kJ/mol(中和热) | |
| D. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0kJ/mol(燃烧热) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8 mol | B. | 2.6 mol | C. | 1.4 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都正确 | B. | ②③④⑤ | C. | ②⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中燃烧的生成物都是过氧化物 | |
| B. | 与水反应的剧烈程度随核电荷数增加而增强 | |
| C. | 最高价氧化物对应水化物的碱性随核电荷数增加而增强 | |
| D. | 还原性随原子电子层数的增加而增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g熔融NaHSO4中含有阳离子的总数为0.1NA | |
| B. | 0.1mol Cl2全部溶于水后转移电子的数目为0.1NA | |
| C. | 常温下,pH=2的醋酸溶液中所含有的H+数为0.01NA | |
| D. | 合成氨反应达平衡时,每断裂3NA个氮氮三键则必生成3NA个氢氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com