
【题目】标准状况下V L氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中正确的是( )
①ρ=(17V+22400)/(22.4+22.4V)
②ω=17c/(1000ρ)
③C=1000ρω/35
④ω=17V/(17V+22400)
⑤c=1000Vρ/(17V+22400)
A.①②④ ⑤ B.②④ ⑤ C. ③④ ⑤ D. ①② ⑤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法,错误的是( )
A.元素周期表是元素按原子序数大小排列而成的
B.元素原子的电子层数等于其所在周期的周期序数
C.元素原子的最外层电子数等于其所在族的族序数
D.元素周期表中共有18列,16个族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是( )
①20 mL 0.01 mol·L-1 KCl溶液
②30 mL 0.02 mol·L-1 CaCl2溶液
③40 mL 0.03 mol·L-1 HCl溶液
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1 AgNO3溶液
A.①>②>③>④>⑤ B.④>①>③>②>⑤
C.⑤>④>②>①>③ D.④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是
A. 稀豆浆、硅酸、氯化铁溶液都属于胶体
B. Na2O、MgO、Al2O3均属于碱性氧化物
C. 氨水、次氯酸都属于弱电解质
D. 葡萄糖、油脂都不属于有机高分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是
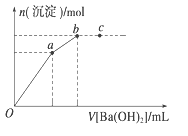
A.a点时溶液中所含主要溶质为(NH4)2SO4
B.a→b段发生反应的离子方程式是 SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C.b点为最大沉淀量,对应的纵坐标值为0.02
D.c点加入Ba(OH)2溶液的体积为200 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:
CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2 mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1 mL | 1 mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2 mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1 mL | 3 mL | 蓝紫色溶液 | 12~13 | ———— |
(1)上表中a、b应为 (填字母序号)。
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4反应的化学方程式 。基于实验1、2的现象可以得出结论:NaOH用量较少时, 。
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其理论依据是 。
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是 。
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4] 2-),由此提出问题:[Cu(OH)4] 2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是 。基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com