
| A. | HCO3-电离的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- | |
| C. | 过量的CO2通入NaOH溶液中:CO2-+2OH-=CO32-+H2O | |
| D. | 新制氢氧化铜(碱性)和乙醛反应:CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$ CH3COOH+Cu2O↓+2H2O |
分析 A.碳酸氢根离子为弱酸的酸式盐的酸根离子,部分电离生成碳酸根离子和氢离子;
B.次氯酸钙与二氧化碳、水反应生成次氯酸和碳酸钙,次氯酸见光分解生成氯化氢和氧气;
C.过量的CO2通入NaOH溶液中生成碳酸氢钠;
D.乙醛和新制氢氧化铜发生氧化反应生成乙酸、氧化亚铜和水.
解答 解:A.H3O+为水合氢离子,碳酸氢根离子为弱酸的酸式盐的酸根离子,HCO3-电离的离子方程式为:HCO3-+H2O?CO32-+H3O+,故A正确;
B.次氯酸钙和二氧化碳、水反应生成次氯酸,次氯酸不稳定,光照易分解,导致漂白粉失效,反应方程式为Ca2++2ClO-+CO2+H2O=2HClO+CaC03、2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+02↑,故B错误;
C.过量的CO2通入NaOH溶液中,二氧化碳和氢氧化钠反应生成碳酸氢盐,离子反应方程式为:CO2+OH-=HCO3-+H2O,故C错误;
D.乙醛和新制Cu(OH)2的反应发生氧化反应,乙醛分子中的醛基被氧化为羧基,氢氧化铜被还原为氧化亚铜红色沉淀:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,乙醛为分子、氢氧化铜为沉淀、乙酸为弱电解质、氧化亚铜为沉淀、水为弱电解质,所以所有的反应物、生成物都应写化学式,不属于离子反应,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度中等,注意D所有的反应物、生成物都应写化学式,不属于离子反应,为易错项.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
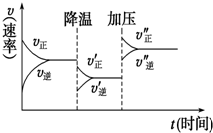 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况.由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况.由此可推断( )| A. | 正反应是放热反应 | B. | D可能是气体 | ||
| C. | 逆反应是放热反应 | D. | A、B、C、D均为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
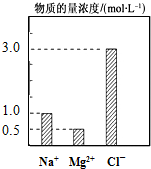 在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在200mL由NaCl、MgCl2、KCl组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | 3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | ||
| C. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | D. | CaO+H2O═Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是4He的同分异构体 | B. | 比 4He少一个中子 | ||
| C. | 比4He少一个质子 | D. | 3He原子核有3个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
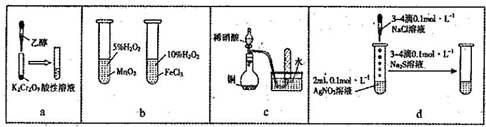
| A. | a图,滴加乙醇,试管中橙色溶液变为绿色,乙醇发生取代反应生成乙酸 | |
| B. | b图,右边试管中产生气泡较为迅速,说明氯化铁的催化效果比二氧化锰好 | |
| C. | c图,根据试管中收集到无色气体,不能验证铜与稀硝酸的反应产物是NO | |
| D. | d图,试管中先有白色沉淀、后有黑色沉淀生成,能确定Ksp(AgCl)>Ksp(Ag2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SbCl4 | PbCl4 |
| 熔点/℃ | -90.4 | -70.4 | 5.2 | 120 | -70.4 | -49.5 | -36.2 | -15 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com