

 .
.分析 单质M是目前使用量最大的金属,则M为Fe;气体单质B与Fe反应生成I,I能与Fe反应生成K,K被B氧化得到I,而I中Fe为+3价,可推知B具有强氧化性,则B为Cl2,I为FeCl3,K为FeCl2;A是日常生活中不可缺少的物质,也是化工生产上的重要原料,电解熔融的A得到B与C,故A为NaCl、C为Na;G为无色液体,与钠反应得到气体E,C在气体F中点燃生成D,D与G反应得到气体F与N,可推知G为H2O,E为H2、F为O2,D为Na2O2,N为NaOH,由转化关系可知,H为Fe3O4,J为HCl,以此解答该题.
(1)由以上分析可知H为Fe3O4,D为Na2O2为离子化合物据此书写电子式;
(2)B为氯气,与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(3)D与G反应是过氧化钠和水反应生成氢氧化钠和氧气;
(4)I为FeCl3,溶液中铁离子水解生成具有吸附性的氢氧化铁胶体;
(5)1摩尔气体E在气体F中完全燃烧生成液态G,是氢气和氧气反应生成液态水,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合热化学方程式书写方法得到;
(6)反应中NaClO是氧化剂,还原产物是NaCl,根据元素守恒,可知反应式中需要补充NaCl和H2O.根据化合价升降法配平方程式.
解答 解:单质M是目前使用量最大的金属,则M为Fe;气体单质B与Fe反应生成I,I能与Fe反应生成K,K被B氧化得到I,而I中Fe为+3价,可推知B具有强氧化性,则B为Cl2,I为FeCl3,K为FeCl2;A是日常生活中不可缺少的物质,也是化工生产上的重要原料,电解熔融的A得到B与C,故A为NaCl、C为Na;G为无色液体,与钠反应得到气体E,C在气体F中点燃生成D,D与G反应得到气体F与N,可推知G为H2O,E为H2、F为O2,D为Na2O2,N为NaOH,由转化关系可知,H为Fe3O4,J为HCl,
(1)由以上分析可知H为Fe3O4,D为Na2O2,过氧化钠是离子化合物,电子式为: ,
,
故答案为:Fe3O4; ;
;
(2)B为氯气,与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)D与G反应是过氧化钠和水反应生成氢氧化钠和氧气,反应的离子方程式为:2OH-+Cl2=Cl-+ClO-+H2O,
故答案为:2OH-+Cl2=Cl-+ClO-+H2O;
(4)I为FeCl3,可说明生成具有吸附性的氢氧化铁胶体,Fe3++3H2O?Fe(OH)3+3H+ Fe(OH)3(胶体)具有较大的表面积,能吸附水中悬浮物质,使水净化,
故答案为:Fe3++3H2O?Fe(OH)3+3H+ Fe(OH)3(胶体)具有较大的表面积,能吸附水中悬浮物质,使水净化;
(5)1摩尔气体E在气体F中完全燃烧生成液态G,是氢气和氧气反应生成液态水,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合热化学方程式书写方法得到热化学方程式为:H2(g)+$\frac{1}{2}$O2 (g)═H2O(l)△H=-akJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2 (g)═H2O(l)△H=-akJ/mol;
(6)反应中FeCl3→Na2FeO4,铁元素化合价由+3价升高为+6价,化合价总升高3价,NaClO→NaCl,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故FeCl3系数为2,NaClO系数为3,由铁元素守恒可知 Na2FeO4系数为2,由氯元素守恒可知NaCl系数为2×3+3=9,根据钠元素守恒可知NaOH系数为9+2×2=13,由氢元素守恒可知H2O系数为5,配平方程式为2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O;
故答案为:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O.
点评 本题考查无机物推断,涉及Na、Fe、Cl元素化合物的性质,需要学生熟练掌握元素化合物知识,注意根据转化关系中特殊反应进行推断,难度中等.


科目:高中化学 来源: 题型:解答题
 实验室制取少量溴乙烷的装置如下图所示,根据题意完成下列填空:
实验室制取少量溴乙烷的装置如下图所示,根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
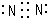 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨转化为金刚石不是化学反应 | |
| B. | 石墨一定没有金刚石稳定 | |
| C. | 金刚石具有能量一定比石墨高 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 常温常压下,46gNO2和N2O4混合气体含有的原子数为3NA | |
| C. | 1molCl2参加的氧化还原反应,反应过程中转移电子数都是2NA | |
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com