
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
反应A(g)+2B(g)=C(g)的反应过程中能量变化如右下图所示。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是
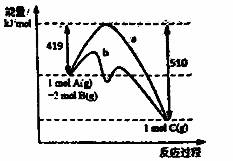
A.该反应是吸热反应
B.催化剂改变了该反应的焓变
C.催化剂降低了该反应的活化能
D.该反应的焓变△H=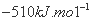
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g) ΔH<0。
zC(g) ΔH<0。
达到化学平衡后测得A的浓度为0.20 mol·L-1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.35 mol·L-1。则下列有关判断正确的是
A.平衡向逆反应方向移动了 B. x+y>z
C.B的转化率下降 D.C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(1)Zn(s) + 1/2O2(g) = ZnO(s) △H=-348.3 kJ/mol
(2)2Ag(s) + 1/2O2(g) = Ag2O(s) △H=-31.0 kJ/mol
则 Zn(s) + Ag2O(s) = ZnO(s) + 2Ag(s) 的△H等于( )
A.+317.3 kJ/mol B.-379.3 kJ/mol
C.-332.8kJ/mol D.-317.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
将钠、镁各O.2 m01分别放入100 mL 1 mol/l的盐酸中, 同温同压下产生的气体体积之比是 ( )
A.1:2 B.1:3 C.2:1 D.1:l
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)向MnSO4和硫酸的混合溶液里加入K2S208(过二硫酸钾),溶液中会发生如下反应:Mn2++ S2082-+H2O→MnO4-+SO42一十H+该反应常用于检验Mn2+的存在。其特征现象是 。
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为 mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO3和H2S04的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBi03+ MnSO4+ H2S04→ Na2S04+ Bi2(S04)3+ NaMnO4+ H2O
①配平上述反应的化学方程式;
②上述反应中还原产物是 。
③用单线桥表示该氧化还原反应
(4)S2O82-在一定条件下,可转变为S2O32-,写出往K2S2O3中滴加稀硫酸的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
化学上用“示踪原子法”来判断反应的历程,下列用“示踪原子法”表示的化学方程式正确的是 ( )
A.5H218O2+2KMnO4+3H2SO4===518O2↑+K2SO4+2MnSO4+8H2O
B.CH3COOH+C2H518OH→CH3COOCH2CH3+H218O
C.2Na2O2+2H218O===4NaOH+18O2↑
D.K37ClO3+6HCl===K37Cl+3Cl2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ:反应产物的定性探究。
实验装置如图所示:(固定装置已略去)
(1)A中反应的化学方程式为 。
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ:反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
| 硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
资料2:X-射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是 __。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol/L
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol/L Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为 _。(已知:2Cu2++4I-===2CuI+I2,2S2O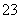 +I2===S4O
+I2===S4O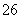 +2I-)
+2I-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com