
| A、向硫的二硫化碳溶液里加入水振荡 |
| B、向溴水里加汽油振荡 |
| C、向碘水里加酒精振荡 |
| D、向溴的煤油溶液里加甲苯振荡 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


| 充电 |
| 放电 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W有如图所示的转化关系,已知△H=△H1+△H2,则X、Y可能是
X、Y、Z、W有如图所示的转化关系,已知△H=△H1+△H2,则X、Y可能是| A、①③④ | B、①②③ |
| C、①② | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| C、分液操作时,分液漏斗中下层液体及上层液体均从下口放出 |
| D、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
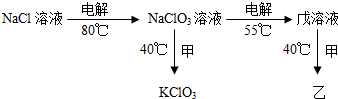 氯元素的常见化合价有-1,0,+1,+3,+4,+5,+7.
氯元素的常见化合价有-1,0,+1,+3,+4,+5,+7.| 生成物的实际产量 |
| 理论产量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH<7的溶液中:SO32-、Cu2+、HClO、K+ |
| B、加入铝粉后产生大量氢气的溶液中:Fe3+、Na+、NO3-、SO42- |
| C、无色透明溶液中:[Ag(NH3)2]+、NH3?H2O、OH-、NO3- |
| D、常温下,水电离出的c(H+)=10-14 mol?L-1的溶液中:Na+、Ca2+、Br-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、SO42-、OH- |
| B、Ag+、NH3?H2O、NO3- |
| C、Ba2+、H+、NO3-、PO43- |
| D、Na+、Al3+、Cl-、SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com