
| 选项 | 操作 | 解释或结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液,出现白色沉淀 | 溶液中一定含有SO42- |
| B | 将某气体通入品红溶液褪色,加热又变红 | 气体为SO2 |
| C | 将气体通过饱和Na2CO3溶液 | 除去CO2中的HCl |
| D | 配制FeSO4溶液时,应加入过量铁粉和稀硫酸 | 溶液中不断产生FeSO4 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、所谓低碳经济,是指在可持续发展理念指导下,尽可能地减少光化学污染气体的排放 |
| B、汽油、柴油和植物油都是碳氢化合物 |
| C、只由一种元素组成的物质,一定是纯净物 |
| D、化学反应的实质就是旧化学键的断裂、新化学键形成过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能与Cu反应产生气体的溶液:Na+、Fe2+、Cl-、SO42- |
| B、滴入甲基橙显红色的溶液:K+、Cu2+、NO3-、I- |
| C、由水电离出的C(H+)?C(OH-)═10-24溶液:K+、Na+、NO3-、Cl- |
| D、无色溶液:K+、Al3+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-
| ||||
B、将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O
| ||||
| C、Fe2O3固体溶于过量氢碘酸溶液中:Fe2O3+6H+═2Fe3++3H2O | ||||
| D、苯酚钠溶液中通入少量的CO2:2C2H5O-+CO2+H2O→2C2H5OH+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾、漂白粉、臭氧的净水原理相同 |
| B、“血液透析”的原理利用了胶体的性质 |
| C、食品包装中常放入有硅胶和铁粉的小袋,防止食物受潮和氧化变质 |
| D、煤炭燃烧、机动车尾气、建筑扬尘等可加重雾霾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容 | 实验目的 | |
| A | 将SO2通入酸性KMnO4溶液中,紫色褪去 | 证明SO2具有漂白性 |
| B | 向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色褪去 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 证明氧化性:Cu2+>Fe3+ |
| D | 向Na2SiO3溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 证明非金属性:Cl>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na>Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca>Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S>C |
| D | t℃时,Br2+H2?2HBr K=5.6×107 I2+H2?2HI K=43 |
非金属性:Br>I |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
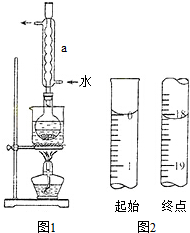 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com