
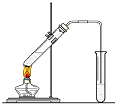
 在实验室我们用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室我们用如图所示的装置制取乙酸乙酯.回答下列问题:分析 (1)实验室用乙酸和乙醇反应制取乙酸乙酯,依据酯化反应的反应历程是羧酸脱羟基醇脱氢书写;
(2)饱和食盐水中,降低了乙酸乙酯的溶解度,同时还能除去混有的乙醇和乙酸;
(3)通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中防止吸收液倒吸;
(4)分离互不相溶的液体的操作是分液;
(5)先判断两种反应物谁过量,按不足量来计算.
解答 解:(1)乙酸和乙醇反应制取乙酸乙酯,发生反应的方程式为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
故答案是:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,产物便于分层,
故答案是:降低酯在其中的溶解度,有利于酯分离;除去粗产品中的乙酸和乙醇;
(3)导管不能插入溶液中,防止饱和碳酸钠溶液吸入反应试管中,
故答案是:防倒吸;
(4)乙酸乙酯不溶于水,可以采用分液操作,分离乙酸乙酯;
故答案是:分液;
(5)30乙酸的物质的量为:30g÷60g/mol═0.5mol,46g乙醇的物质的量为1mol,根据方程式:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,应按乙酸完全反应来计算理论产生乙酸乙酯的量为0.5mol,质量为0.5mol×88g/mol=44g,实际产量为0.44g×60%=26.4g,
故答案为:26.4g.
点评 本题考查乙酸乙酯的制备、有关化学方程式的简单计算,题目难度中等,注意实验的基本操作以及饱和碳酸钠溶液的作用,根据化学方程式的计算是易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向稀硫酸中滴加NaOH:2H++2OH-═2H2O | |
| B. | 向A1C13溶液中加入氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 向BaCl2溶液通入CO2:Ba2++CO2+H2O═BaCO3↓+2 H+ | |
| D. | 硫酸与氢氧化钡溶液反应:H++OH-+LV+Ba2++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不含I- | B. | 可能含有Cu2+ | C. | 一定含有SO32- | D. | 肯定不含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
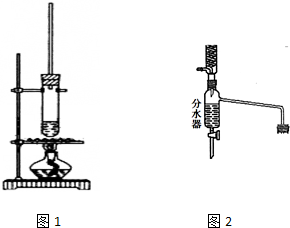 乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯
乙酸正丁酯常用作香精,实验室用冰醋酸和正丁醇制备乙酸正丁酯| 物质 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 0.810 | 118.0 | 9 |
| 冰醋酸 | 1.049 | 118.1 | 互溶 |
| 乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
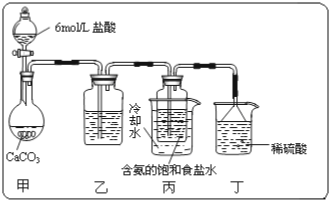
 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物加热,并通入水蒸气,就可以完成“高温下,Fe与水蒸气的反应实验”.
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物加热,并通入水蒸气,就可以完成“高温下,Fe与水蒸气的反应实验”.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸和碱反应生成1mol水时所放出的热 | |
| B. | 1mol酸和1mol碱反应生成盐和水时所放出的热 | |
| C. | 强酸稀溶液和强碱稀溶液反应生成1mol液态水时所放出的热 | |
| D. | 稀Ba(OH)2和稀H2SO4完全反应生成1mol水时所放出的热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com