
 .
. ,A与等物质的量的H2完全加成后,得到烃C,用系统命名法给C命名2-甲基丁烷.
,A与等物质的量的H2完全加成后,得到烃C,用系统命名法给C命名2-甲基丁烷. 分析 1mol某烃A完全燃烧生成5mol CO2和5mol H2O,根据原子守恒可知A的分子式为C5H10,A在一定条件下发生加聚反应,生成高聚物B,说明A含有双键,
(1)乙烯分子中所有原子都处于同一平面上,根据乙烯的结构确定该物质的结构;
(2)根据聚合物质主链上至少2个碳原子,剩余的3个碳原子形成1个甲基和一个乙基来确定结构;
(3)若B的主链上所接的支链都为甲基,则A应为 ,A与等物质的量的H2完全加成后,得到烃C,C为CH3CH(CH3)CH2CH3,以此解答该题.
,A与等物质的量的H2完全加成后,得到烃C,C为CH3CH(CH3)CH2CH3,以此解答该题.
解答 解:1mol某烃A完全燃烧生成5mol CO2和5mol H2O,根据原子守恒可知A的分子式为C5H10,A在一定条件下发生加聚反应,生成高聚物B,说明A含有双键,
(1)若A为(CH3)2C=CHCH3,则碳原子都在同一个平面上,故答案为:能;
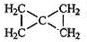
(2)聚合物质主链上至少2个碳原子,剩余的3个碳原子形成1个甲基和一个乙基,即两种不同支链,所以B的结构简式可能为 ,
,
故答案为: ;
;
(3)若B的主链上所接的支链都为甲基,则A应为 ,A与等物质的量的H2完全加成后,得到烃C,C为CH3CH(CH3)CH2CH3,名称为2-甲基丁烷,
,A与等物质的量的H2完全加成后,得到烃C,C为CH3CH(CH3)CH2CH3,名称为2-甲基丁烷,
故答案为: ;2-甲基丁烷.
;2-甲基丁烷.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析、计算能力的考查,注意把握有机物的结构特点,难度不大.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
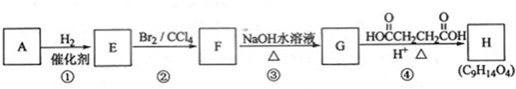
 ;
;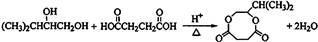 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn+CuSO4=Cu+ZnSO4 | B. | CH4+O2=CO2+H2O | ||
| C. | NaOH+HCl=NaCl+H2O | D. | 2NaOH+2Al+2H2O=2NaAlO2+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| B. | 硫酸铜溶液显酸性:Cu2++2H2O=Cu(OH)2↓+2H+ | |
| C. | 向碳酸氢铵溶液中加过量澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成3n molX,同时生成n mol Y | |
| B. | X的生成速率与Z的生成速率相等 | |
| C. | X、Y、Z的浓度不再改变 | |
| D. | X、Y、Z的分子个数比为3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-COOH | B. | CH2=CH-CH2OH | C. | CH2=CH-CHO | D. | CH2=CH-COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com