
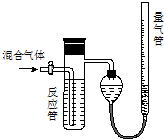
分析 (1)SO2、N2、O2混合气体进入反应管,SO2被吸收,气体体积的膨胀值为量气管内增加的水的体积,等于N2和O2的体积;
(2)在测量氢气体积时,为了使测量更为准确,要注意上下移动水准管,使左右两管的液面相平,以使量气管中的气压与大气气压相等,读数时视线应与左管内凹液面最低处相平,以减少观察误差.
(3)反应管内溶液蓝色消失时,SO2与反应管内所含的I2恰好反应,若没及时停止通气,则未反应的SO2气体也排水到量气管,使N2、O2体积增加,测得SO2的含量降低;
(4)根据反应:SO2+I2+2H2O═H2SO4+2HI,V(SO2)=Vm×n(I2)=Vac×10-3mol×22400 mL•mol-1=22.4Va•c mL,据此计算解答.
解答 解:(1)混合气体进入反应管中,其中SO2与I2发生反应:SO2+I2+2H2O=H2SO4+2HI不产生气体,剩余的气体仅有N2和O2,量气管内增加的水的体积等于N2和O2的总体积,
故答案为:N2、O2;
(2)读数时,要注意视线应于量气管凹液面的最低处保持水平;每次读数前应上下移动水准管,待两管液面相平再读数是为了防止水的压强造成的误差
故答案为:调整量器筒内外液面高度相平;平视凹液面读数;
(3)根据反应:SO2+I2+2H2O═H2SO4+2HI可求出吸收的SO2的体积:V(SO2)=Vm×n(I2),SO2的体积百分含量φ(SO2)=$\frac{V(S{O}_{2})}{V(混合气体)}$式中V(SO2)的量是由n(I2)的物质的量决定的,而“没有及时停止通气”就会使得V(混合气体)增大,则φ(SO2)偏低,
故答案为:偏低;
(4)由所给反应知SO2气体的物质的量等于碘的物质的量Va×10-3L×c mol•L-1=Vac×10-3mol,其体积为V(SO2)=Vac×10-3mol×22400 mL•mol-1=22.4Va•c mL,所以SO2的体积百分含量为=$\frac{22.4cVa}{22.4Va+Vb}$×100%,即SO2的百分含量为:$\frac{22.4cVa}{22.4Va+Vb}$×100%,
故答案为:$\frac{22.4cVa}{22.4Va+Vb}$×100%.
点评 本题考查的是二氧化硫的性质、实验误差的判断、指示剂的选择,难点在于SO2含量误差分析和SO2的百分含量计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;取代反应;
;取代反应; ;取代反应;
;取代反应; ;加聚反应;
;加聚反应; CH3CH2OOCCOOCH2CH3+2H2O;酯化反应;
CH3CH2OOCCOOCH2CH3+2H2O;酯化反应;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯气是一种化学性质活泼的非金属单质,工业上
氯气是一种化学性质活泼的非金属单质,工业上查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴到铁片上:Fe+H+═Fe2++H2↑ | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-═Cu(OH)2↓ | |
| C. | 碳酸钠溶液与稀盐酸反应:CO32-+2H+═H2CO3 | |
| D. | 碳酸氢钠溶液与盐酸混合:HCO3-+H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com