
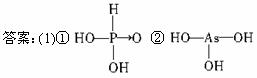
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可推出它们的结构式分别为:①________________,②____________________。
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:①____________________,②____________________。?
(3)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况,写出化学方程式。?
_______________________________________________________________
解析: (1)已知H3PO3为中强酸,H3AsO3为弱酸,依题给信息可知H3PO3中含1个非羟基氧原子,H3AsO3中不含非羟基氧原子。?
(2)与过量NaOH溶液反应方程式的书写,需得知H3PO3和H3AsO3分别为几元酸,从题给信息可知,含氧酸分子结构中含几个羟基氢,则该酸为几元酸。故H3PO3为二元酸,H3AsO3为三元酸。?
(3)H3PO3为中强酸,不与盐酸反应,H3AsO3为两性物质,可与盐酸反应。?
(2)①H3PO3+2NaOH![]() Na2HPO3+2H2O?
Na2HPO3+2H2O?
②H3AsO3+3NaOH![]() Na3AsO3+3H2O?
Na3AsO3+3H2O?
(3)H3PO3为中强酸,不与盐酸反应,H3AsO3可与盐酸反应。
As(OH)3+3HCl![]() AsCl3+3H2O
AsCl3+3H2O


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
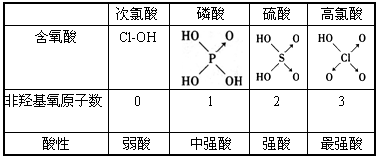
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH |  |
 |
 |
| 非羟基 氧原子数 |
0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |




查看答案和解析>>
科目:高中化学 来源:2011--2012学年四川省高二上学期期中考试化学试卷 题型:填空题
(8分)判断含氧酸强弱的一条经验规律:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。几种实例如下表所示。
|
|
次氯酸 |
磷酸 |
硫酸 |
高氯酸 |
|
含氧酸 |
|
|
|
|
|
非羟基 氧原子数 |
0 |
1 |
2 |
3 |
|
酸性 |
弱酸 |
中强酸 |
强酸 |
最强酸 |
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)的分子式相似,但它们的酸性差别很大。亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,由此可推出它们的结构式分别为:
亚磷酸_____________________________________________,
亚砷酸_______________________________________。
(2)分别写出亚磷酸和亚砷酸与过量的NaOH溶液反应的化学方程式。
亚磷酸:___________________________________________,
亚砷酸:________________________________________________。
(3)在亚磷酸和亚砷酸中分别加入浓盐酸,分析反应情况,可以反应的用化学方程式表示。
亚磷酸:__________________________________________________
亚砷酸_________________________________________________。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2011--2012学年四川省成都二十中高二上学期期中考试化学试卷 题型:填空题
(8分)判断含氧酸强弱的一条经验规律:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。几种实例如下表所示。
| | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 含氧酸 | 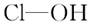 | 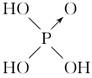 |  | 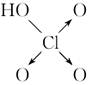 |
| 非羟基 氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com