
(1)下表列有四种物质的沸点
| 物质 | NaCl | MgCl2 | AlCl3 | SiCl4 |
| 沸点/℃ | 1465 | 1412 | 181(升华) | 57.6 |
①从表中的数据,结合学过的化学知识,你能得到的规律是 。
②以上四种物质中,属于共价化合物的是 。
③若你得到的规律具有普遍性,则以下两种物质的沸点高低是:LiCl BCl3(填“>”、“==”、“<”)。
(2)在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。
回答下列问题:
①平衡时CO的转化率为 ,该反应的化学平衡常数为 。
②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
③427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“==”、“<”)。
(1)①第三周期元素的氯化物,自钠到硅,键型由离子化合物过渡到共价化合物,沸点显著地降低。(2分) ②SiCl4、AlCl3(2分) ③ ﹥(1分)
(2)①50%(1分),1(1分)②增大(1分),66.7%(或0.667)(2分)③ ﹤(1分)
(1)①从表中数据可以看出它们的沸点依次降低,且前面两种物质的沸点远高于后面两种,由晶体结构的有关知识可知,它们应属于不同的晶体类型,前两个为典型的金属与典型的非金属形成的化合物,应为离子化合物,属于离子晶体,所以沸点较高;后两者沸点很低只能是属于分子晶体,是共价化合物;所以可得出的规律是:第三周期元素的氯化物,自钠到硅,键型由离子化合物过渡到共价化合物,沸点显著地降低。②由前面分析可知为SiCl4、AlCl3共价化合物;③从上面的规律可知排在周期表左边的氯化物的沸点比在右边的要高,而Li在B的左边,故LiCl >BCl3;
(2)① CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始: 1 1 0 0
转化: 0.5 0.5 0.5 0.5
平衡: 0.5 0.5 0.5 0.5
平衡时CO的转化率为:50%,又因为平衡时各物质的浓度相等,故平衡常数为1。
②增大一种反应物的浓度可以提高其它反应物的转化率而自己本身的转化率要降低,故如果继续向该平衡体系中通入1.0mol的水,CO的转化率将增大。
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始: 1 2 0 0
转化: n n n n
平衡: 1—n 2—n n n
K=n×n/(1—n)(2—n)=1 所以n=2/3 故CO的转化率为66.7%
③由800℃变到427℃,平衡常数由1增大到9.4,故降温平衡向正反应方向移动,
所以△H<0.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
 (2009?海口模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
(2009?海口模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:| 元素 | Mn | Fe | |
| 电离能/kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 示)位于该正方体的顶点和面心,该化合物的化学式是
示)位于该正方体的顶点和面心,该化合物的化学式是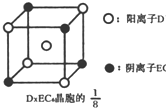
| 元素 | Mn | Fe | |
| 电离 能/kJ?mol-1 |
Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元素 | Mn | Fe | |
| 电离能( kJ?mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省襄阳市高二下学期四校联考期中考试化学试卷(带解析) 题型:填空题
(10分)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
| 元素 | 25Mn | 26Fe | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省泰安市高三第一轮复习质量检测化学试卷(解析版) 题型:填空题
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:

回答下列问题:
(1)Mn元素价电子的电子排布式为??????????????????????? ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fen再失去一个电子难。其原因是??????????????? 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是???????????? 。
②络离子[Fe(CN)6]4-的配体CN-中C原子的杂化轨道类型是??????????? ,写出一种与 CN-互为等电子体的单质分子的电子式?????????????????????????? 。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为???????????????? 。
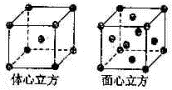
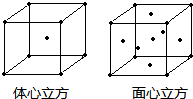
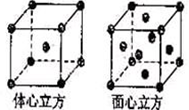
(4)金属铁晶体在不同的温度下有两种堆积方式,如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为????????????? 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com