
| A. | NaOH,KOH,CsOH碱性依次减弱 | B. | HCl,PH3,H2S稳定性依次减弱 | ||
| C. | Na,Mg,Al还原性依次减弱 | D. | S2-,Cl-,Ca2+半径依次增大 |
分析 A.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
B.元素的非金属性越强,对应的氢化物的稳定性越强;
C.同周期元素从左到右,元素的金属性逐渐减弱,对应的金属单质的还原性减弱;
D.核外电子排布相同的离子,核电荷数越大离子半径越小.
解答 解:A.金属性Na<K<Cs,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故A错误;
B.非金属性Cl>S>P,元素的非金属性越强,对应的氢化物的稳定性越强,故B错误;
C.同周期元素从左到右,元素的金属性逐渐减弱,对应的金属单质的还原性减弱,故C正确;
D.S2-,Cl-,Ca2+的核外电子排布相同,核电荷数越大离子半径越小,应为S2->Cl->Ca2+,故D错误.
故选C.
点评 本题考查元素周期律知识,为高考高频考点,侧重于学生的分析能力的考查,注意把握元素的性质与对应单质、化合物的性质的关系以及比较角度,难度不大.


科目:高中化学 来源: 题型:解答题
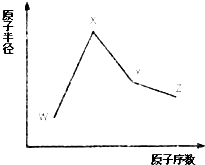 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.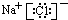 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
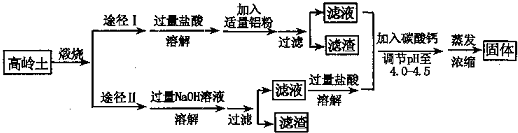
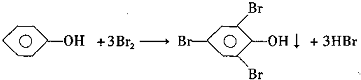
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
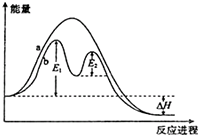
| A. | 反应过程a有催化剂参与 | |
| B. | 改变催化剂,可改变该反应的活化能 | |
| C. | 该反应为吸热反应,热效应等于△H | |
| D. | 加入催化剂,可以提升反应物的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中的碳原子不在同一条直线上 | B. | 光照下能够发生取代反应 | ||
| C. | 比丁烷更容易液化 | D. | 是石油分馏的一种产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为($\frac{7}{22.4}$)NA | |
| B. | 1mol羟基(-OH)所含的电子总数为10NA | |
| C. | 硝化甘油、火棉、TNT都是硝酸酯 | |
| D. | 1mol碳正离子(CH3+)所含的电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时,温度计水银球的位置应插入烧瓶的溶液中 | |
| B. | 配制溶液时,摇匀后发现液面低于刻度,加少量水至溶液凹液面恰好与刻度线相切 | |
| C. | 容量瓶用蒸馏水清洗后应烘干后使用 | |
| D. | 实验室制取蒸馏水时,冷凝管水流方向应从下到上,与蒸汽流动方向相反 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com