
����Ŀ���۴�����ϩ�����ϼ���Ӧ�ù㷺�������Ǹ��л���ĺϳ�·�ߣ�

��ʾ���ټ����ڵ绡������������Ȳ����
��CH3C��CH![]() CH3CH2CHO(δ��ƽ)��
CH3CH2CHO(δ��ƽ)��
��ش��������⣺
��1������ϳ�A�Ļ�ѧ��Ӧ��ԭ��������Ϊ________��
��2��B�Ľṹ��ʽΪ________��
��3��B����C�ķ�Ӧ�г�����Cu(OH)2����Һ���Ҫ��������________��
��4��A��C��Ӧ����D�ķ�Ӧ������________��
��5��д����D���� ��Ӧ�Ļ�ѧ����ʽ��____________________________________________________��
��Ӧ�Ļ�ѧ����ʽ��____________________________________________________��
��6��д���ܼ�����ˮ��ɫ����ʹ��ɫʯ����Һ����D��ͬ���칹��Ľṹ��ʽ��_____________________________________��
���𰸡�81.25% CH3CHO ���� �ӳɷ�Ӧ  CH2===CHCH2COOH��CH3CH===CHCOOH��
CH2===CHCH2COOH��CH3CH===CHCOOH��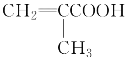
��������
������Ŀ��ʾ��Ϣ����Ͼ۴�����ϩ���Ľṹ��ʽ����֪A����Ȳ��B����ȩ��C�����ᣬ����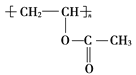 ����D��D��
����D��D��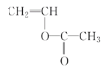 ��
��
�������Ϸ�������1��2���Ӽ���ϳ�![]() �Ļ�ѧ��Ӧ��ԭ��������Ϊ
�Ļ�ѧ��Ӧ��ԭ��������Ϊ![]() 81.25%����2��B����ȩ����ȩ�Ľṹ��ʽΪCH3CHO����3����ȩ������Cu(OH)2����Һ�����������ᣬ���Ի���Ҫ�������Ǽ�������4��
81.25%����2��B����ȩ����ȩ�Ľṹ��ʽΪCH3CHO����3����ȩ������Cu(OH)2����Һ�����������ᣬ���Ի���Ҫ�������Ǽ�������4��![]() ��CH3COOH��Ӧ����
��CH3COOH��Ӧ����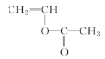 �ķ�Ӧ�����Ǽӳɷ�Ӧ��
�ķ�Ӧ�����Ǽӳɷ�Ӧ��
��5��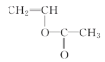 �����Ӿ۷�Ӧ����
�����Ӿ۷�Ӧ����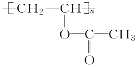 ����Ӧ�Ļ�ѧ����ʽ��
����Ӧ�Ļ�ѧ����ʽ�� ��
��
��6����ʹ��ˮ��ɫ˵������̼̼˫������ʹ��ɫʯ����Һ���˵�������Ȼ��� 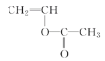 ��ͬ���칹��Ľṹ��ʽ��CH2=CHCH2COOH��CH3CH=CHCOOH��
��ͬ���칹��Ľṹ��ʽ��CH2=CHCH2COOH��CH3CH=CHCOOH��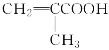 ��
��


 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д� ����ѧ��Ӯ�����ϵ�д�
����ѧ��Ӯ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����ա�
���������ʣ�
�� ��
��![]() ��
��![]() ��C4H8
��C4H8
��CH2==CH��CH==CH2 ��C3H6 ��![]() ��
��![]()
��HOCH2CH2COOH ��HOCH2OCH2CHO
��1�����л�Ϊͬϵ�����____________________������ţ�����Ϊͬ���칹�����____________________������ţ���
��2��д������HClһ�������·���1,4�ӳɷ�Ӧ�Ļ�ѧ����ʽ_______________________��
��3����ϵͳ�����������ʢٺ����ʢ�������
�� ___________________________��
___________________________��
�� ![]() ____________________________��
____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ���ܴﵽ������ʵ��Ŀ�ĵ���

A������װ�üȿ��Խ���ʯ�͵ķ���Ҳ���Խ��оƾ���Ũ��
B������װ���ҿ������ʵ�����Ʊ���ϩ���岢������ϩ���������
C������װ�ñ��������ʵ�����Ʊ���Ȳ���岢������Ȳ���������
D������װ�ö��������ʵ�����Ʊ������������ռ���Ϊ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����˲ⶨ����Ħ�������̽��ʵ�飬��������طֽ���O2��

ʵ�鲽�����£�
�����Ӻ�ʵ��װ�ã����װ�õ������ԡ�
��������������ط�ĩ�������������̷�ĩ��Ͼ��ȣ����������Թ��У�ȷ�����Թܺ�ҩƷ��������Ϊ15.95 g��
�����ȣ���ʼ��Ӧ��ֱ���������������Ϊֹ��
������������Ͳ��ˮ�����Ϊ285.0 mL������ɱ�״�������������Ϊ279. 7 mL��
��ȷ�����ԹܺͲ����������Ϊ15. 55 g��
��������ʵ����̣��ش��������⣺
(1)��μ��װ�õ������ԣ�____________________________________________��
(2)�����Dz����ռ������������������ļ������裺
��������Ͳ�ĸ߶�ʹ���ƿ����Ͳ�ڵ�Һ��߶���ͬ��
��ʹ�Թܺ��ƿ�����嶼��ȴ�����£�
����ȡ��Ͳ��Һ��������
��������������ȷ˳����_________________(����д�������)��
��������ʵ�����ʱ�������Ӷ��������ȡ���������_______(�ƫ��ƫС������Ӱ�족)��
(3)ʵ������в������������ʵ�����_____mol��ʵ��������������Ħ�������______(����С�������λ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��P4(g)��6Cl2(g)===4PCl3(g) ��H��a kJ��mol��1��
P4(g)��10Cl2(g)===4PCl5(g) ��H��b kJ��mol��1��
��֪�γɻ��1 mol��ѧ���ų������յ�������Ϊ�û�ѧ���ļ��ܡ�P4������������ṹ��PCl5��P��Cl���ļ���Ϊc kJ��mol��1��PCl3��P��Cl���ļ���Ϊ1.2c kJ��mol��1������������ȷ����
A. P��P���ļ��ܴ���P��Cl���ļ���
B. ����Cl2(g)��PCl3(g)===PCl5(s)�ķ�Ӧ����H
C. Cl��Cl���ļ���Ϊ(b��a��5.6c)/4 kJ��mol��1
D. P��P���ļ���Ϊ(5a��3b��12c)/8 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�ص��⻯����������ڹ�ҵ�����ͷ������ж��й㷺��Ӧ�ã���ش��������⣺
��1����������N2��H2��Ӧ��ȡ��N2��g��+3H2��g��2NH3��g����Ӧ���̵������仯��ͼ��ʾ����֪1molN2�����еĻ�ѧ������ʱ��Ҫ����942kJ��������1molH2�����еĻ�ѧ������ʱ��Ҫ����436kJ���������γ�1molN��H��ʱ�ͷ�390.8kJ��������

��ͼ��E�Ĵ�С�Ը÷�Ӧ������Ӱ�죿____________________________���÷�Ӧ��Ҫ������ý��������������ý��ʹͼ��B�������ǽ��ͣ�______________________������_________________��
��ͼ����H=___kJ/mol��
�������Ӧ����v��H2��Ϊ0.15mol/��Lmin������v��N2��=_____________mol/��Lmin����v��NH3��=_________________________________________��
��2���¿���Ϊ�����������ȼ�ϣ���������N2O4��Ӧ����N2��ˮ������
��֪��N2��g��+2O2��g��=N2O4��l�� ��H=��19.5kJmol��1
N2H4��l��+O2��g��=N2��g��+2H2O��g����H=��534.2kJmol��1
��д���º� N2O4��Ӧ���Ȼ�ѧ��Ӧ����ʽ_______________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ1�Ǽס��ҡ������ֹ������ʵ��ܽ�����ߣ�ͼ2��30��ʱ��ȡ�������ֹ����1g�ֱ�Ž�ʢ��10gˮ����֧�Թ��У��������ܽ����������˵����ȷ���ǣ� ��
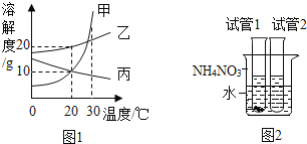
A. �����ʵ��ܽ�ȱ������ʵ��ܽ�ȴ�
B. �����Թ�1�Ĺ����DZ�
C. ���ձ��м���NH4NO3������Թ�2��һ���о�������
D. ��30��ʱ�ס��ҡ����������ʵı�����Һ��100g������20�棬������Һ�����ʵ����������Ĵ�С��ϵ���ң���=��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨп�̵��Ͳ��������Ҫ�ɷ�ΪMnO2��NH4Cl��ZnCl2�ȡ�ij�о�С��̽�����ڵ���ڵĺ�ɫ���岢��������ʱ��������ͼ��ʾʵ�顣�����й�ʵ���������ȷ����

A. �������в�������������ת�ƹ��� B. ������Ϊ�������õ�����Һ�Լ���
C. ��������ʢ��ҩƷ������������ D. ��������Ŀ���dz�ȥ�����е�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ϡ��������NOx���õ�HNO3��HNO2�Ļ����Һ�����û����Һ�ɻ�ý�Ũ�����ᡣд�����ʱ�����ĵ缫��Ӧʽ��________________________��
��2���Ʊ�����������Na2S2O5Ҳ�ɲ�������Ĥ��⼼����װ����ͼ��ʾ������SO2������Һ�к���NaHSO3��Na2SO3�������ĵ缫��ӦʽΪ____________������__________�ҵ�NaHSO3Ũ�����ӡ���������Һ���нᾧ��ˮ���ɵõ�Na2S2O5��

��3���������ӽ���Ĥ���Ƶ��Һ��OH����Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ���õ�ص�������ӦʽΪ____________________��(���ӽ���Ĥֻ����OH��ͨ��)
 .
.
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com