
 图是气体摩尔体积测定装置.
图是气体摩尔体积测定装置.分析 (1)依据图中仪器形状说出仪器的名称;依据实验目的,测定气体摩尔体积,可知该实验要求装置不能漏气;
(2)镁与稀硫酸反应生成氢气,用到的稀硫酸需要用针筒通过加料口进入气体发生器;
(3)依据Mg~H2,计算生成1mol氢气的体积Vm.
解答 解:(1)依据图中a仪器形状可知,其名称为储液瓶;依据实验目的,测定气体摩尔体积,可知该实验要求装置不能漏气,所以实验前应先检查是否漏水;
故答案为:储液瓶;
(2)镁与稀硫酸反应生成氢气,用到的稀硫酸需要用针筒通过加料口进入气体发生器;
故答案为:针筒;
(3)依据Mg~H2,设生成1mol氢气体积为Vm则;
24g Vm
0.120g 0.129250L
解得Vm=25.85L
故答案为:25.85L.
点评 本题考查了气体摩尔体积的测定,明确实验原理和装置特点即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 如图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构.实验测得金属钨的密度为19.30g•cm-3,钨的相对原子质量是183.9.假设金属钨原子为等径刚性球,试完成下列问题:
如图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构.实验测得金属钨的密度为19.30g•cm-3,钨的相对原子质量是183.9.假设金属钨原子为等径刚性球,试完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

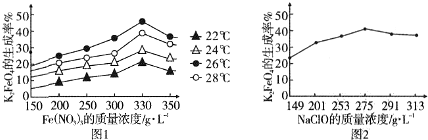
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉被氧化了 | |
| B. | 有色布条被空气中的氧气氧化了 | |
| C. | 漂白粉跟空气中的 CO2反应充分,生成了较多量的 HClO | |
| D. | 漂白粉溶液蒸发掉部分水,其浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436 | 243 | 431 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
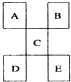
| A. | D一定足金属元素,其金属性比C强 | |
| B. | C的最高价氧化物水化物显强酸性 | |
| C. | E的原子序数一定是A的5倍,且原予半径比A大 | |
| D. | B的氢化物是以分子形式存在,且分子间存在氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com