
【题目】(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇。已知某些化学键的键能数据如下表:
化学键 C—C C—H H—H C—O ![]() H—O
H—O
键能/kJ·mol-1 348 413 436 358 1 072 463
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为 。
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2 L的密闭容器内充入1 mol CO和2 mol H2,加入合适催化剂(体积可以忽略不计)后在250 ℃开始反应,并用压力计监测容器内压强的变化如下:

则从反应开始到20 min时,以CO表示的平均反应速率= ,该温度下平衡常数K= ,若升高温度则K值 (填“增大”、“减小”或“不变”)。
(3)下列描述中能说明上述反应已达平衡的是 。
A.2v(H2)正=v(CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成2n mol H2
(Ⅱ)回答下列问题:
(1)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则Ka(HX) Ka(CH3COOH)(填“>”、“<”或“=”)。
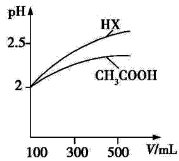
(2)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)= mol·L-1(填精确值)。
【答案】(Ⅰ)(1)CO(g)+2H2(g)![]() CH3OH(g) ΔH=-116 kJ/mol (2)0.012 5 mol/(L·min) 4
CH3OH(g) ΔH=-116 kJ/mol (2)0.012 5 mol/(L·min) 4
减小 (3)BC (Ⅱ)(1)> (2)9.9×10-7
【解析】本题考查了化学反应中的能量变化、化学反应速率与化学平衡、溶液中的平衡等,意在考查考生运用所学知识分析、解决综合问题的能力。(Ⅰ)(1)CO和H2化合来制备甲醇的反应为CO(g)+2H2(g)![]() CH3OH(g),化学反应的过程就是旧化学键断裂和新化学键形成的过程,旧化学键断裂吸收热量,新化学键形成放出热量,该反应的ΔH=1 072 kJ·mol-1+2×436 kJ·mol-1-(3×413 kJ·mol-1+358 kJ·mol-1+463 kJ·mol-1)=-116 kJ·mol-1。
CH3OH(g),化学反应的过程就是旧化学键断裂和新化学键形成的过程,旧化学键断裂吸收热量,新化学键形成放出热量,该反应的ΔH=1 072 kJ·mol-1+2×436 kJ·mol-1-(3×413 kJ·mol-1+358 kJ·mol-1+463 kJ·mol-1)=-116 kJ·mol-1。
(2)设转化的CO为x mol·L-1,

=,解得x=0.25,v(CO)==0.012 5 mol/(L·min),K===4。该反应为放热反应,故升高温度K值减小。(3)当v(H2)正=2v(CH3OH)逆时能说明反应已达平衡,A项错误;容器内气体的总质量为恒量,而容器中气体的总物质的量为“变量”,根据=,可知气体的平均摩尔质量为“变量”,“变量”不变时可说明反应已达平衡,B项正确;容器体积不变,该反应为气体分子数减小的反应,故容器内气体的压强保持不变能说明反应已达平衡,C项正确;D项指的是同一个反应方向,错误。(Ⅱ)(1)稀释时,酸的pH变化越大,酸性越强,其电离常数越大。(2)根据电荷守恒得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),故c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=1.0×10-6 mol·L-1-1.0×10-8 mol·L-1=9.9×10-7 mol·L-1。


科目:高中化学 来源: 题型:
【题目】I、某研究性学习小组为了验证CH4是否具有还原性,设计了如下实验:
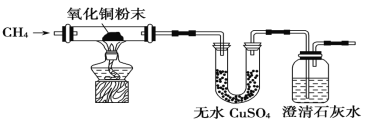
(1)实验过程中观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为____ __ 。
(2)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是____ 。
请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图)___ ________ _____ 。
II、(1)工业上用电石-乙炔生产氯乙烯的反应如下:CaO+3C![]() CaC2+CO
CaC2+CO
CaC2+2H2O![]() CH≡CH+Ca(OH)2 CH≡CH+HCl
CH≡CH+Ca(OH)2 CH≡CH+HCl ![]() CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖与石油资源。
电石-乙炔法的缺点是: 、 。
(2)已知ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。请设计以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对于杂质(括号中的物质为杂质)的检验和除杂方法均正确的是
选项 | 目标物质和杂质 | 检验方法 | 除杂方法 |
A | FeCl2(FeCl3) | 滴入KSCN | 通入过量氯气 |
B | NaCl(NH4Cl) | 加热 | 加热 |
C | KNO3(NaCl) | 焰色反应(透过蓝色钴玻璃) | 重结晶 |
D | Cl2(HCl) | 通入AgNO3溶液 | 通入饱和NaCl溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,并说明理由 。
(2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法 是 。
(3)上述装置图中,B的名称是 ,D仪器的名称是 。
(4)B仪器使用前必须进行的操作是 。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分液时,正丁醛在 层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是 ,为更好的控制温度,可以采取的改进措施是 。
(7)本实验中,正丁醛的产率为 %。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌具有很强的抑制作用,工业上常用对羟基苯甲酸和丁醇在浓硫酸催化作用下进行酯化反应制得。以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
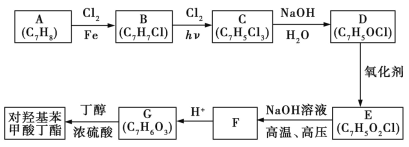
已知:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液发生银镜反应;
③F的核磁共振氢谱表明其有两种不同化学环境的氢原子,且峰面积之比为1∶1。
请回答下列问题:
(1)由B生成C的化学方程式为 ,该反应过程中涉及的反应类型是 。
(2)遇FeCl3溶液显紫色且能发生银镜反应的G的同分异构体有 种,G在一定条件下可以发生反应生成高分子化合物,试写出该反应的化学方程式: 。
(3)D的结构简式为 ,D与银氨溶液发生反应的化学方程式为 。
(4)设计出以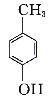 为原料制备G(
为原料制备G(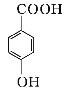 )的合成路线: 。
)的合成路线: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些古文或谚语包含了丰富的化学知识,下列解释不正确的是( )
选项 | 古文或谚语 | 化学解释 |
A | 日照香炉生紫烟 | 碘的升华 |
B | 以曾青涂铁,铁赤色如铜 | 置换反应 |
C | 煮豆燃豆萁 | 化学能转化为热能 |
D | 雷雨肥庄稼 | 自然固氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)在200mLNa2CO3与NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,见下图一所示。
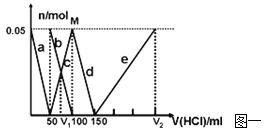
(1)原混合溶液中Na2CO3的物质的量浓度为 mol·L-1
(2)V1: V2= 。
(3)若滴加盐酸过程中得到沉淀0.975g,则滴入盐酸的体积可能为 mL。
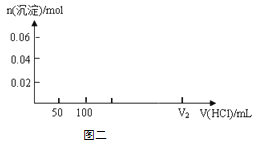
(4)在上图二坐标中画出该混合溶液中逐滴加入1mol·L-1的盐酸,所得沉淀的物质的量与加入盐酸溶液的体积变化关系。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)镁燃烧不能用CO2灭火,用化学方程式表示其理由 。
(2)用H2O2和稀H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,请写出表示该过程的化学方程式 。
(3)在NaAlO2溶液中通入过量的CO2 (用离子方程式表示)
(4)污水及自来水处理的方法有很多。
Fe2(SO4)3 净水的原理是 。
使用时发现Fe2(SO4)3 并不能使酸性废水中的悬浮物沉降除去,其原因是 。
在酸性环境下,向含重铬酸根的废水中加入FeSO4溶液,然后调节pH,使生成的Cr3+转化为Cr(OH)3,写出第一步反应的离子方程式 。
(5)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+,则下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
①硫酸铝和氨水 ②偏铝酸钠和稀盐酸 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com