
某化学兴趣小组用下面所示装置制取氯酸钾、次氯酸钠和氯水并进行探究实验。

实验I.制取氮酸钾、次氯酸钠和氯水
(1)写出装置A实验室制取Cl2的化学反应方程式________________________________。
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、_________、_________。为提高氯酸钾和次氯酸钠的产率,在实验装置中还需要改进的是_________。
(3)装置 C 中反应需要在冰水浴中进行,其原因是________________________________。
(4)装置D中的实验现象是溶液先变红后褪色,最后又变为_________色。
实验Ⅱ 尾气处理
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响)
①提出合理假设
假设1:只存在SO32- ;假设2:既不存在SO32-也不存在ClO-;假设 3:_________。
②设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3mol/L H2SO4、1mol/LNaOH 溶液、0.01mol/L 酸性 KMnO4 溶液、淀粉 KI 溶液。
实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液分置于A、B试管中 | |
步骤2:向A试管中滴加0.01mol/L酸性 | (1)若溶液褪色,则假设1成立 |
KMnO4溶液 | (2)若溶液不褪色,则假设2或3成立 |
步骤3:_____ | _____ |
科目:高中化学 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:选择题
根据元素周期律和物质结构的有关知识,以下有关排序正确的是( )
A. 离子半径:Ca2+>Cl->S2-
B. 第一电离能:Si>C>N
C. 电负性:F>S>Mg
D. 热稳定性:SiH4>H2S>H2O
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次摸底考试理综化学试卷(解析版) 题型:选择题
化学与生活密切相关。下列有关说法错误的是
A. SO2和NO2是主要的大气污染物
B. 大气中的SO2和CO2溶于水形成酸雨
C. 以液化石油气代替燃油可减少大气污染
D. 对煤燃烧后形成的烟气脱硫,目前主要用石灰法
查看答案和解析>>
科目:高中化学 来源:2017届上海市普陀区高三第二学期质量调研(二模)化学试卷(解析版) 题型:选择题
分子式为CnH2n+1Cl( n>l)的卤代烃不能发生消去反应,n的最小值是
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源:2017届上海市普陀区高三第二学期质量调研(二模)化学试卷(解析版) 题型:选择题
不能用单质直接反应得到的是
A. NaCl B. MgCl2 C. AlC13 D. FcC12
查看答案和解析>>
科目:高中化学 来源:2017届山西省太原市高三模拟考试(一)理综化学试卷(解析版) 题型:选择题
在周期表中,X元素与Y、Z、W三种元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种短周期元素原子的最外层电子数之和为20 ,下列判断正确的是( )
A. 原子半径:rW<rX<rY
B. 四种元素行成的单质最多有6种
C. 四种元素均可与氢元素形成18电子分子
D. 四种元素中,Z的最高价氧化物对应的水化物的酸性最强
查看答案和解析>>
科目:高中化学 来源:2017届山东省济南市高三第一次模拟考试理科综合化学试卷(解析版) 题型:简答题
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。回答下列问题:
(l)汽车发动机工作时会引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。2000K时,向容积为2L的密闭容器中充入2molN2与2molO2,发生上述反应,经过5min达到平衡,此时容器内NO的体积分数为0.75% .则该反应在5min内的平均反应速率v(O2)=_______mol/(Lmin),N2的平衡转化率为_______,2000K时该反应的平衡常数K=_____。
2NO(g),是导致汽车尾气中含有NO的原因之一。2000K时,向容积为2L的密闭容器中充入2molN2与2molO2,发生上述反应,经过5min达到平衡,此时容器内NO的体积分数为0.75% .则该反应在5min内的平均反应速率v(O2)=_______mol/(Lmin),N2的平衡转化率为_______,2000K时该反应的平衡常数K=_____。
(2)一定量NO发生分解的过程中,NO的转化率随时间变化的关系如右图所示。

① 反应2NO(g) N2(g)+O2(g)为______反应(填“吸热”或“放热”) ;
N2(g)+O2(g)为______反应(填“吸热”或“放热”) ;
②一定温度下,能够说明反应2NO(g) N2(g)+O2(g)已达到平衡的是_____(填序号);
N2(g)+O2(g)已达到平衡的是_____(填序号);
a.容器内的压强不发生变化
b.混合气体的密度不发生变化
c. 2NO、N2、O2的浓度保持不变
d.单位时间内分解4molNO,同时生成2molN2
③ 在四个容积和温度均完全相同的密闭容器中分别加入下列物质,相应物质的量(mol)如下表所示。相同条件下达到平衡后,N2的体积分数最大的是_______(填容器代号);
容器代号 | NO | N2 | O2 |
A | 2 | 0 | 0 |
B | 0 | l | l |
C | 0.4 | 0.6 | 0.8 |
D | l | 0.5 | 0.4 |
(3)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx。可用CH4催化还原NOx以消除氮氧化物污染。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
①写出CH4与NO反应生成N2、CO2、H2O(g)的热化学方程式:___________;
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
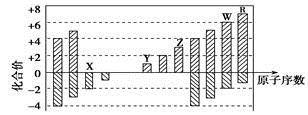
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R<W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二3月月考化学试卷(解析版) 题型:简答题
(I)(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理____________,哪些违反了洪特规则_______________。哪些既没有违反泡利原理又没有违反洪特规则_______________。

(Ⅱ)等电子原理:原子数相同、最外层电子总数相同的分子互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第二周期元素组成的分子中,互为等电子体的是:______和______;______和______.
(2)此后,等电子原理又有所发展.例如,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征.在短周期元素组成的物质中,与NO2-互为等电子体的分子有:______、______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com