
【题目】分析下图所示的四个原电池装置,其中结论正确的是( )

A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,电极反应式为2H2O+2e-===2OH-+H2↑
C. ③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作正极,电极反应式为2H++2e-===H2↑
【答案】B
【解析】
A.根据氧化还原反应,失电子的极是负极;B.原电池的正极发生得电子的还原反应;C.金属铁在常温下遇浓硝酸钝化;D.铁、铜、氯化钠构成的原电池中,金属铁发生的是吸氧腐蚀。
A.②中自发的氧化还原反应为金属铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,失电子的是金属铝,Al为负极,③中金属铁在常温下遇浓硝酸钝化,Cu为负极,故A错误;B. ②中自发的氧化还原反应为金属铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,失电子的是金属铝,Al为负极,Mg作为正极,电极反应式为2H2O+2e-═2OH-+H2↑,故B正确;C.金属铁在常温下遇浓硝酸钝化,Cu为负极,Fe为正极,Fe极电极反应式为NO3-+e-+2H+=NO2↑+H2O,故C错误;D.铁、铜、氯化钠构成的原电池中,金属铁为负极,金属铜为正极,由于NaCl溶液呈中性,铁发生的是吸氧腐蚀,正极上是氧气得电子的过程,故D错误;本题选B。


科目:高中化学 来源: 题型:
【题目】工业合成氨反应:N2+3H2![]() 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可________(填“吸收”或“放出”)热量________kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是________________________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,反应经过10 min后,生成10 mol NH3,则用N2表示的化学反应速率为________mol·L-1·min-1。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B两种有机物的有关信息:
A | B |
①分子模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是__________(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2-CH2
(2)A与H2发生加成反应后生成X,与X在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=_________时,这类们机物开始出现同分异构休。
(3)B与乙醇反应的化学方程式为_____________,反应类型为_______________。
(4)以A为原料可直接生产一种高分子化合物P,则P的结构简式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表一部分,列出了十个元素在周期表中的位置:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
请用化学用语回答下列问题
(1)在③~⑦元素中,原子半径最大的是_______________(填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是_______________(填物质化学式),呈两性的氢氧化物是_____________(填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,/span>M中含有的化学键类型有________________________;
(4)用电子式表示元素③与⑧形成化合物的过程_________________________________。
(5)写出含有32个电子的元素⑥的氢化物的分子式:_____________________________。
(6)写出工业冶炼⑤的化学方程式:____________________________________
(7)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-=2Cl-+Br2 第二步:____________________________ ; 第三步Cl2+2Br-=2Cl-+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是在法国拍卖会拍卖的我国圆明园兽首﹣﹣兔首和鼠首,拍卖台上渴望回家的铜器兔首和鼠首看上去仍熠熠生辉.下列对其原因的分析,最可能的是( )

A.它们的表面都电镀上了一层耐腐蚀的黄金
B.环境污染日趋严重,它们表面的铜绿被酸雨溶液洗去
C.铜的活动性比氢弱,因此不易被氧化
D.它们是含一定比例金、银、锡、锌的铜合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,其中NH3被氧化为常见的无毒物质。下列说法错误的是( )

A. 溶液中OH-向电极a移动
B. 电极b上发生还原反应
C. 负极的电极反应为2NH3-6e-+6OH-![]() N2+6H2O
N2+6H2O
D. 理论反应消耗的NH3与O2的物质的量之比为3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
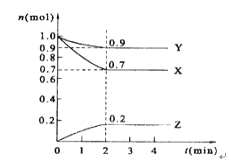
(1)X的转化率是_______;
(2)由图中所给数据进行分析,该反应的化学方程式为_______________;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=__________;
(4)当反应进行到第___min,该反应达到平衡。若三种物质都是气体,平衡时Y所占体积的百分比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃下,分别在三个容积为10L的恒容绝热密闭容器中,发生反应:2CO(g)+SO2(g)![]() S(g)+2CO2(g) ΔH>0,测得相关数据如下表所示。
S(g)+2CO2(g) ΔH>0,测得相关数据如下表所示。
容器 | 起始时物质的量/mol | 平衡时CO2(g)的物质的量/mol | |||
CO(g) | SO2(g) | S(g) | CO2(g) | ||
甲 | 1 | 0.5 | 0.5 | 0 | a |
乙 | 1 | 0.5 | 0 | 0 | 0.8 |
丙 | 2 | 1 | 0 | 0 | b |
下列说法正确的是
A. 其他条件不变,容器乙达到平衡后,再充入体系中四种气体各1mol,平衡逆向移动
B. b=1.6
C. 平衡常数:K甲>K乙
D. 其他条件不变,向容器甲再充入1mol CO,平衡常数(K)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com