
����Ŀ��ͼΪ����;���Ʊ�����Ĺ��̣���Ӧ�����ԣ�����˵��������ǣ� �� 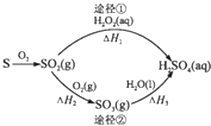
A.��֪S��l��+O2��g���TSO2��g����H=��293.23kJmol��1 �� ��S��s��+O2��g���TSO2��g����Ӧ�ų�������С��293.23 kJ/mol
B.��1 mol H2SO4��Ũ��Һ������NaOH��Ӧ���ų���������Ϊ�к���
C.;������SO2��SO3����������������
D.����H1����H2+��H3 �� ��2H2O2��aq���T2H2O��l��+O2��g��Ϊ���ȷ�Ӧ
���𰸡�B
���������⣺A�����ڹ�̬ʱ���е�����С��Һ̬�����������ȼ�շų�������С��293.23 kJ/mol����A��ȷ��
B����l mol H2S04��Ũ��Һ������NaOH��Ӧ����2molˮ����Ũ��Һ����ˮ���ȣ����Ը÷�Ӧ�ų������������к��ȣ���B����
C��������������������Ӧ����ֱ�Ϊ�����ᡢ���ᣬ�����������������������������������C��ȷ��
D�����ڡ�H1����H2+��H3 �� ˵����H1�Ƕ���������˫��ˮ��Ӧ���ʱ��H4��˫��ˮ�ֽ���ʱ��H5֮�ͣ����ݸ�˹���ɡ�H4=��H2+��H3 �� ��˫��ˮ�ֽ���ʱ��H5=��H1������H2+��H3����0����ֵС��0��˵��2H2O2��aq���T2H2O��l��+O2��g��Ϊ���ȷ�Ӧ����D��ȷ��
��ѡB��
�����㾫�������÷�Ӧ�Ⱥ��ʱ����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪�ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������£�����ѡ������ʾ�����ʼ�ת������һ��ʵ�ֵ��ǣ� ��
A.Al2O3 ![]() ?NaAlO2��aq��
?NaAlO2��aq�� ![]() ?Al��OH��3
?Al��OH��3
B.S ![]() ?SO3
?SO3 ![]() ?H2SO4
?H2SO4
C.Mg��OH��2 ![]() ?MgCl2��aq��
?MgCl2��aq�� ![]() ��ˮMgCl2
��ˮMgCl2
D.Fe ![]() ?Fe2O3
?Fe2O3 ![]() ?FeCl3
?FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������У��ֱ��������ƣ�����������������
A. ��ˮ�ƾ� B. �� C. ����ˮ D. 75%�ľƾ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��ӻ������м����ɴ�С������˳����( )
��CO32- ��NH3 ��H2O ��SiF4 ��CO2
A.�ݢܢ٢ڢ�B.�ܢ٢ڢݢ�
C.�ݢ٢ܢڢ�D.�ۢڢܢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͨ���䲿���Ϻ����������л��������ͳ�ϵ�������������ʽ�������������Ͷ�ܵ�����ʽ���ⲢͶ��ʹ�á�þ��ˮ��ؿ�Ϊ�����ṩ��Դ����װ����ͼ��ʾ�������й�þ��ˮ��ص�˵����ȷ����

A. Mg�缫�Ϸ�����ԭ��Ӧ
B. �õ�ع���һ��ʱ��������Һ��������
C. �����ĵ缫��ӦʽΪH2O2+2e-+2H+=2H2O
D. ����ع���ʱת��2 mol���ӣ�����2 mol H+�����ӽ���Ĥ������Ҳ�Ǩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH2OH(�ǰ�)��һ����ɫ��״�ᾧ���ǰ��������ೣ�����л��ϳɵĻ�ԭ�����ش��������⣺
(1) NH2OH�ĵ���ʽΪ________________��
(2)�������Ʊ��ǰ����ܷ�ӦΪ2NO2-+4SO2+6H2O+6NH3=4SO42-+6NH4++2NH2OH���÷�Ӧ��NH3__________(��������������������ԭ���������Ȳ����������ֲ�����ԭ��������
(3)����ʱ��NH2OH�ᷢ���ֽⷴӦ���ֽ��������ɫ������Ũ����������̣�������Ӵ���Ϊ����ɫ������ֽ�����ʹ��ˮCuSO4����ɫ����NH2OH�ֽⷴӦ�Ļ�ѧ����ʽΪ______________________��
(4)����ԭNO���Ʊ������ǰ���һ�ַ������䷴Ӧԭ�����£�2NO+3H2+2HCl![]() 2NH2OH��HCl��ijУ����ѧϰС���ͬѧ�������ͼ��ʾװ���Ʊ������ǰ���
2NH2OH��HCl��ijУ����ѧϰС���ͬѧ�������ͼ��ʾװ���Ʊ������ǰ���

�ٸ�ʵ�����˵ļ��ȷ�ʽΪ______________��
��װ���е���X��������_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������������ͬ����������ǣ� ��
A. ���ʯ�ʹ�����ʯ B. Na2O2��Na2O C. ���Ͱ��� D. I2��I-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2CO��g��+O2��g��=2CO2��g����H=��566kJmol��1
2Na2O2��s��+2CO2��g��=2Na2CO3��s��+O2��g����H=��452kJmol��1
���������Ȼ�ѧ����ʽ�жϣ�����˵����ȷ���ǣ� ��
A.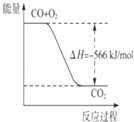
ͼ�ɱ�ʾ��CO����CO2�ķ�Ӧ���̺�������ϵ
B.CO��ȼ����Ϊ566 kJ/mol
C.Na2O2��s��+CO2��s��=Na2CO3��s��+ ![]() ?O2��g����H=��226 kJ/mol
?O2��g����H=��226 kJ/mol
D.CO��g����Na2O2��s����Ӧ�ų�509 kJ����ʱ������ת����Ϊ2��6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.4mol��L-1��Ԫ��HA��0.2mol��L-1NaOH��Һ�������Ϻ�������ҺpH>7����Һ��������ּ�Ũ������ͼ��ʾ������˵����ȷ����

A. HA������
B. ͼ��δ��ʾ��������Ũ��С��0.lmol/L
C. �û����Һ�У�c(HA)+c (X)=c(Na+)
D. ͼ��M��ʾHA��Y��ʾOH-��Z��ʾH+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com