
(1)以甲基橙为指示剂时,V![]() 与V
与V![]() 的关系是 。?
的关系是 。?
(2)以酚酞为指示剂时,V![]() 与V
与V![]() 的关系是 。
的关系是 。
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:阅读理解
| 80(V2-V1)c |
| W |
| 80(V2-V1)c |
| W |
查看答案和解析>>
科目:高中化学 来源: 题型:
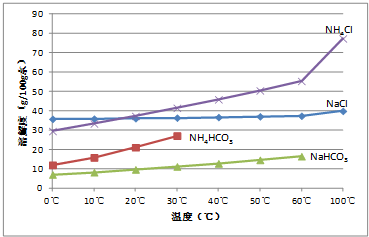
查看答案和解析>>
科目:高中化学 来源: 题型:
A.石蕊,由蓝变红 B.酚酞,红色褪去
C.甲基橙,由橙变黄 D.甲基橙,由黄变橙
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:实验题
为探究铜与浓硫酸的反应,甲、乙两同学分别设计了图1、图2所示装置,将足量铜和10 mL 18 mol·L-1浓硫酸共热,直到无气体生成为止(假定反应前后试管中溶液的体积不变)。


 图1
图2
图1
图2
(1)比较两实验装置,图2装置的优点是:① ;② 。
(2)①甲根据所学的化学知识认为还有一定量的硫酸剩余。甲认为硫酸剩余的理论依据是 。
②下列药品中能够用来证明反应结束后的烧瓶中确有硫酸剩余的是_______。(选填编号)
A.过量铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)乙在拆除图2装置前,不打开胶塞,为使装置中的残留气体完全被吸收,应当采取的操作是 。
(4)为定量测定当剩余硫酸浓度不大于何值时,铜与硫酸就不能反应,甲、乙两位同学进行了如下设计:
①甲方案:将产生的气体缓缓通过预先称量过的盛有 的干燥管,反应结束后再次称量,干燥管质量增加m g。其余酸浓度为 mol·L-1。
②乙方案:分离出反应后的溶液并加蒸馏水稀释至1 000 mL,取20.00 mL于锥形瓶中,滴入2~3滴 ,(选填“酚酞”、“甲基橙”)用0.1000mol·L-1标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),用去NaOH溶液V mL。其余酸浓度为 mol·L-1。
③甲、乙两方案比较,你认为误差较大的是 ,理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com