
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡的是___________。
A.![]()
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:__________________________。
③氨基甲酸铵分解反应的焓变△H_________0,熵变△S________0(填>、<或=)。
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
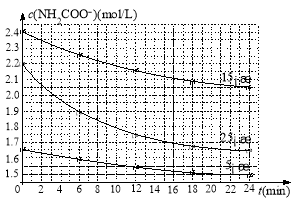
计算25℃时,0~6min氨基甲酸铵水解反应的平均速率_______________________。
【答案】(1)①BC;②K=c2(NH3)·c(CO2)=(2c/3)2(1c/3)=1.6×10-8(mol·L-1)3③>,>
(2)⑤0.05mol·L-1·min-1;
【解析】
试题分析:①A.2v(NH3)=v(CO2),不能说明正逆反应速率相等,不一定是平衡状态,A错误;B.反应是一个前后系数和变化的反应,密闭容器中总压强不变,证明达到了平衡状态,B正确;C.密闭容器中混合气体的密度ρ=m/V,质量不守恒,分子变化,V不变,容器中总密度不变,证明达到了平衡状态,C正确;D.密闭容器中氨气和二氧化碳的体积比始终不变,则氨气的体积分数不变,不能证明达到平恒状态,D错误;答案选BC;
②反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)的K=c2(NH3)c(CO2),设二氧化碳浓度的变化量x,
2NH3(g)+CO2(g)的K=c2(NH3)c(CO2),设二氧化碳浓度的变化量x,
NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
初始浓度: 0 0
变化浓度: 2x x
平衡浓度: 2x x
则3x=4.8×10-3mol/L,即x=1.6×10-3mol/L,K=1.6×10-3mol/L×(3.2×10-3)2≈1.6×10-8(molL-1)3;
③根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡正向移动,反应是吸热的,反应物是固体,产物是气体,该反应是熵增加的过程,即△H>0;
(2)化学反应速率V=△c/△t=( 2.2mol/L1.9mol/L)/6min=0.05mol/(Lmin)。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2+2H2O↑。下列有关该反应的说法正确的是
2ClO2↑+K2SO4+2CO2+2H2O↑。下列有关该反应的说法正确的是
A. H2C2O4是氧化剂 B. KClO3是还原剂
C. H2C2O4在反应中被氧化 D. 1molKClO3参加反应有2mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸的下列性质中,可以证明它是弱电解质的是( )
A. 1mol/L甲酸溶液的c(H+)=10-2mol/L; B. 甲酸以任何比与水互溶;
C. 10mL1mol/L甲酸恰好与10mL1mol/LNaOH溶液完全反应; D. 甲酸溶液的导电性比盐酸溶液弱;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4 ·7H2O的流程如下。
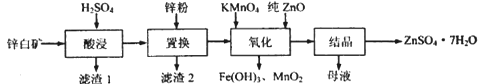
相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)“滤渣1”的主要成分为_________(填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________(填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________。
(3)“氧化”一步中,发生反应的离子方程式为_______________________。溶液pH控制在[3.2,6.4)之间的目的是________________。
(4)“母液”中含有的盐类物质有_________ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用如下反应,可实现氯的循环利用:
4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1
2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1
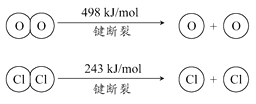
下列说法正确的是
A. 升高温度能提高HCl的转化率
B. 加入催化剂,能使该反应的焓变减小
C. 1molCl2转化为2molCl2原子放出243kJ热量
D. 断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,pH=9的NaOH溶液和CH3COONa两种溶液中,假设由水电离产生的OH- 离子浓度分别为a和b,则a与b的关系为( )
A. a>b B. a=10﹣4b C. b=10﹣4a D. a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古语说:“人要实,火要虚。”此话的意思是做人要脚踏实地,才能事业有成;可燃物燃烧要架空一些,才能燃烧更旺。“火要虚”的目的是
A. 降低可燃物的着火点 B. 增大空气中氧气的含量
C. 升高可燃物的着火点 D. 增大可燃物与氧气的接触面积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。在硫酸的生产中,最关键的一步反应为2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
(1)一定条件下,SO2与O2反应10min后,若SO2和SO3的物质的量浓度分别为1mol/L和3mol/L,则SO2起始物质的量浓度为____________________;10min内生成SO3的平均反应速率v(SO3)为____。
(2)下列关于该反应的说法正确的是_________(填选项字母)。
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率
D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中,若某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是___________(填选项字母)。
A.O2为0.2mol/L B. SO2为0.25mol/L
C.SO3为0.4mol/L D. SO2、SO3均为0.15mol/L
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101KPa时:
2 SO2(g)+ O2(g)2SO3(g)△H1=-197kJmol-1;
H2O(g)═H2O(l)△H2=-44kJmol-1;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJmol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是____________________。
(5)工业制硫酸,用过量的氨水对SO2进行尾气处理,该反应的离子方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com