
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH﹣ ④NH4+ ⑤Fe(CO)5⑥Fe(SCN)3⑦H3O+
⑧[Ag(NH3)2]OH ⑨[B(OH)4]﹣ .
A.①②④⑦⑧
B.③④⑤⑥⑦⑨
C.①④⑤⑥⑦⑧⑨
D.全部
【答案】C
【解析】解:①氢离子提供空轨道,N2H4氮原子提供孤电子对,所以能形成配位键,N2H5+含有配位键,故①正确;
②甲烷中碳原子满足8电子稳定结构,氢原子满足2电子稳定结构,无空轨道,无孤电子对,CH4不含有配位键,故②错误;
③OH﹣电子式为 ![]() ,无空轨道,OH﹣不含有配位键,故③错误;
,无空轨道,OH﹣不含有配位键,故③错误;
④氨气分子中氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH4+含有配位键,故④正确;
⑤Fe(CO)5中Fe原子提供空轨道,CO提供孤对电子,可以形成配位键,故⑤正确;
⑥SCN﹣的电子式 ![]() ,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键,故⑥正确;
,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键,故⑥正确;
⑦H3O+中O提供孤电子对,H+提供空轨道,二者形成配位键,H3O+含有配位键,故⑦正确;
⑧Ag+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,[Ag(NH3)2]OH含有配位键,故⑧正确;
⑨[B(OH)4]﹣离子中氧原子含有孤电子对,硼原子含有空轨道,B3+与OH﹣之间形成配位键,所以含有配位键,故⑨正确.
故选C.


科目:高中化学 来源: 题型:
【题目】下图曲线①表示某种酶在各种温度下酶活性相对最高酶活性的百分比;曲线②是将该种酶在不同温度下保温足够长的时间,再在酶活性最高的温度下测其残余酶活性,由此得到酶的热稳定性数据。请回答下列问题:

(1)固定化酶的常用方法有________________。
(2)曲线②中,35℃和90℃的数据点是在______________℃时测得的。
(3)该种酶固定化后运用于生产,最佳温度范围是_______________,原因是______________。
(4)研究发现有甲、乙两种物质能降低该种酶的催化效率。已知该酶催化的底物浓度变化会改变甲物质对酶的影响,而不会改变乙物质对酶的影响。下图一是降低酶活性的两种机制模型;图二曲线是在酶的活性不受抑制时,起始反应速率与底物浓度的关系。

①符合甲、乙物质对酶影响的模型分别是______________、_______________。
②请在答题卡的指定位置画出加入甲物质时,起始反应速率与底物浓度之间的关系曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.32 g O2占有的体积约为22.4 L
B.22.4 L N2含阿伏加德罗常数个氮分子
C.在标准状况下,22.4 L水的质量约为18 g
D.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化. 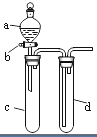
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是 .
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是 .
方案 | 反应物 |
甲 | Cu、浓HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 .
(4)该小组还用上述装置进行实验证明酸性:HCl>H2CO3>H2SiO3 , 则分液漏斗a中加入的试剂是 , c中加入的试剂是 , d中加入的试剂是;实验现象为 . 但此实验存在不足之处,改进的措施是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在250mL某混合溶液中,HNO3和H2SO4物质的量浓度分别为0.2molL﹣1和0.1molL﹣1 . 向该混合溶液中加入1.92克铜粉,加热充分反应.
(1)写出该反应的离子方程式 .
(2)计算所得溶液中Cu2+的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在使用分液漏斗进行分液时,正确的操作是( )
A. 上层液体经漏斗下口放出
B. 分离液体时,将漏斗拿在手上进行分离
C. 分离液体时,使分液漏斗口上的小孔与大气相通,打开活塞
D. 分液漏斗中盛装的是液体,振荡后不必扭开活塞把气体放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量的SO2通入Fe(NO3)3中,溶液逐渐由棕黄色变为浅绿色,但又立即变为棕黄色,继续滴入BaCl2溶液,产生白色沉淀。在上述一系列变化过程中,最终被还原的元素是
A.SB.FeC.ClD.N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示
注:KNO3固体容易受热分解;HNO3易挥发.
(1)沉淀A的主要成分是、(填化学式).
(2)②中反应的化学方程式是 .
(3)③进行的实验操作是(填操作名称).
(4)③加入过量的K2CO3溶液的目的是 .
(5)为了除去溶液3中的杂质,可向其中加入适量的 . 从此溶液获得KNO3晶体的操作是、、过滤.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是( )
A.NaHCO3═Na++H++CO ![]()
B.NaHSO4(溶液)═Na++H++SO ![]()
C.MgCl2═Mg2++2Cl﹣
D.Ba(OH)2═Ba2++2OH﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com