
【题目】下列烯烃中存在顺反异构体的是( )
A.丙烯B.1-丁烯C.2-戊烯D.2-甲基-2-丁烯
科目:高中化学 来源: 题型:
【题目】有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8 g该有机物燃烧生成44.0 g CO2和14.4 g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的C≡C键,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1。
(1)A的分子式是____________。
(2)下列物质中,一定条件下能与A发生反应的是_________________。
A.H2B.Na C.酸性KMnO4溶液 D.Br2
(3)A的结构简式是________________________。
(4)有机物B是A的同分异构体,1 mol B可与1 mol Br2加成。该有机物中所有碳原子在同一个平面上,没有顺反异构现象。B的结构简式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有、无催化剂时,HI分解反应的能量随反应进程的变化关系如图所示,下列说法正确的是
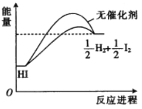
A.其他条件不变时,升高温度,平衡体系中HI的含量降低
B.图示中无催化剂的反应焓变更高
C.其他条件不变时,增大压强,可提高HI的平衡转化率
D.催化剂可提高分子的能量,加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是
A. 此法的优点之一是原料来源丰富
B. ①②③步骤的目的是从海水中获取MgCl2
C. 第④步电解得到,镁的方程式为MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
D. 提取镁的过程涉及化合、分解、置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中,可以使0.10mol/LCH3COOH溶液中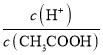 值增大的措施是_______________(填序号)。
值增大的措施是_______________(填序号)。
a.加水稀释b.加入少量CH3COONa固体 c.加入少量冰醋酸d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(2)t℃时,水的离子积常数Kw=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则a+b=_________。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:_______________________;该混合溶液中:c(A-)-c(Na+)=______________________mol/L(填数值)。
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。(已知25℃时电离常数:H2CO3 K1=4.4×10-7,K2=4.7×10-11;HClO K=3.0×10-8;CH3COOH K=1.8×10-5)
①三种溶液pH由小到大的顺序为:_______________________________(填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3)_____c(CO32-)(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银分别放入:
a.100mL蒸馏水中;
b.100mL0.2mol/LAgNO3溶液中;
c.100mL0.1mol/L氯化铝溶液中;
d.100mL0.1mol/L盐酸溶液中。
充分搅抖后,相同温度下银离子浓度由大到小的顺序是________________(填写序号);b中氯离子的浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
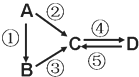
(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出②反应的离子方程式_________;④反应离子方程式__________。
(2)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水高温下反应的化学方程式_______________________。④反应的离子方程式______________。D中加入氢氧化钠的现象__________。
(3)若A是太阳能电池用的光伏材料,B常用用于制作高档光学器材,C、D为钠盐,C的水溶液俗称泡花碱,D的溶液显碱性。④反应也是通入一种引起温室效应的主要气体。写出③反应的化学方程式________________________。⑤反应用到B,反应条件为高温,则⑤的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)

实验过程:
Ⅰ.打开弹簧夹,打开活塞 a,滴加浓盐酸
Ⅱ.当 B 和 C 中的溶液都变为黄色时,夹紧弹簧夹
Ⅲ.当 B 中溶液由黄色变为棕红色时,关闭活塞 a
Ⅳ.…
(1)A 中反应的化学方程式为:____KMnO4+_____HCl(浓)═____ KCl+____MnCl2+____Cl2↑+____H2O,则氧化性 KMnO4________Cl2(填“>”“<”或“=”).
(2)验证氯气的氧化性强于碘的实验现象是__________
(3)过程Ⅲ的实验目的是__________
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是__________。
(5)浸有 NaOH溶液的棉花团的作用是__________。此处发生 的化学方程式是__________。
(6)氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl- < Br- < CN- < SCN- < I-。试写出:
a.(CN)2 与 KOH 反应的化学方程式__________;
b.在 NaBr 和 KSCN 的混合溶液中加入(CN)2 的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
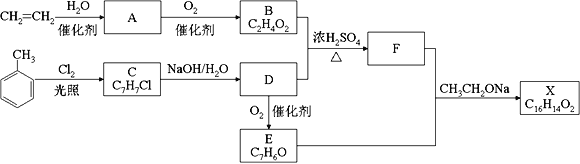
已知:RX![]() ROH;RCHO+CH3COOR’
ROH;RCHO+CH3COOR’![]() RCH=CHCOOR’
RCH=CHCOOR’
请回答:
(1) A中官能团的名称是______________________。
(2) D→E的化学方程式________________________________________________。
(3) X的结构简式_________________。
(4)与F互为同分异构体又满足下列条件的有_______种。
①遇到氯化铁溶液会显紫色,②会发生银镜反应 ③苯环上有三个取代基
在其它同分异构体中核磁共振氢谱有六组峰,氢原子数比符合1:2:2:2:2:1的结构为_____。
(5)根据上面合成信息及试剂,写出以乙烯为原料(无机试剂任选),写出合成CH3CH=CHCOOCH2CH3路线_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有4种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:Ba2+、H+、Na+、NH![]() 、CO
、CO![]() 、NO
、NO![]() 、OH-、SO
、OH-、SO![]() ,将这4种溶液分别标记为A、B、C、D并进行如下实验:
,将这4种溶液分别标记为A、B、C、D并进行如下实验:
①在A或D中滴入C,均有沉淀生成;②A和B反应生成的气体能被D吸收;
③A和D反应生成的气体能被B吸收。
试回答下列问题:
(1)A的化学式是________。
(2)写出其他几种物质的化学式:B________、C________、D________。
(3)写出实验③中有关反应的离子方程式________、__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com