
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是
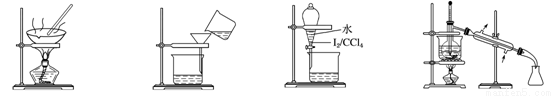
A.灼烧 B.过滤 C.分液 D.蒸馏
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
下列化合物属于弱电解质的是( )
A.HCl B.Ba(OH)2 C.CO2 D.NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
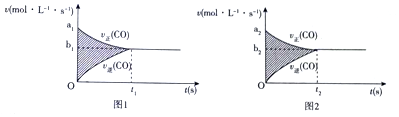
下列实验方法或装置正确的是( )

A. 用图1所示装置制取乙烯
B. 用图2所示方法验证HCl气体易溶于水
C. 用图3所示方法探究固体表面积对反应速率的影响
D. 用图4所示方法检验溴乙烷与NaOH醇溶液共热产生乙烯
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:填空题
查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4?(绿色)、Cr2O72?(橙红色)、CrO42?(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)铬(24Cr)属于_______________(选填编号)。
a.主族元素 b.副族元素 c.Ⅷ族元素 d.过渡元素
(2)铬单质是银白色有金属光泽的固体,有较高的熔点,是最硬的金属;与Ni等添加到Fe中可制成不锈钢。比较硬度:纯铁_________不锈钢;熔点:纯铁__________不锈钢(填“>”“<”或“=”)。
(3)Cr(OH)3与Al(OH)3的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是___________________。
(4)CrO42?和Cr2O72?在溶液中可相互转化。室温下,初始浓度为1.0 mol·L?1的Na2CrO4溶液中c(Cr2O72?)随c(H+)的变化如图所示。
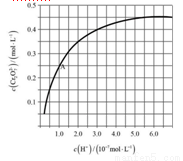
①用离子方程式表示Na2CrO4溶液中的转化反应____________________。
②由图可知,溶液酸性增大,CrO42?的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42?的平衡转化率减小,则该反应的ΔH__________0(填“>”“<”或“=”)。
(5)+6价铬的化合物毒性较大,但其化合物用途广泛。如:“酒精检测仪”可检查司机是否酒驾,其反应原理为:m C2H5OH+ n X + p H2SO4═ g Cr2(SO4)3 + w CO2↑+ 9H2O,其中X的化学式最有可能为__________。常用NaHSO3将酸性废液中的Cr2O72?还原成Cr3+,该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙苯催化脱氢生产苯乙烯的反应:
乙苯催化脱氢生产苯乙烯的反应: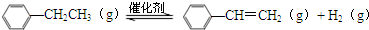
化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol/L | B. | 2.0mol/L | C. | 1mol/L | D. | 2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙和盐酸反应 CO32-+2H+=H2O+CO2↑ | |
| B. | 向氢氧化钡溶液中加硫酸溶液 Ba2++SO42-=BaSO4↓ | |
| C. | 碳酸氢钙溶液与盐酸溶液反应 HCO3-+H+=H2O+CO2↑ | |
| D. | 向稀盐酸溶液中加铁粉 3Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com