
| A. | a L | B. | $\frac{a}{2}$ L | C. | $\frac{a}{3}$ L | D. | 无法计算 |
分析 发生反应:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,由方程式可知消耗氧气体积为CO和H2的混合总体积的$\frac{1}{2}$,以此解答该题.
解答 解:发生反应:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,由方程式可知消耗氧气体积为CO和H2的混合总体积的$\frac{1}{2}$,
即消耗氧气体积为a L×$\frac{1}{2}$=$\frac{a}{2}$ L,
故选B.
点评 本题考查混合物反应有关计算,明确发生反应即可解答,旨在考查学生分析计算能力,难度不大.


 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色气体,难溶于水,密度比空气略小 | |
| B. | 乙烯燃烧时,火焰明亮,同时产生黑烟 | |
| C. | 与溴水发生取代反应而使溴水褪色 | |
| D. | 乙烯的产量标志着一个国家的石油化工水平 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2所含的原子数目为NA | |
| B. | 0.5mol H2O含有的原子数目为1.5NA | |
| C. | 1mol H2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氧气分子的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体(n)的关系如右图 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
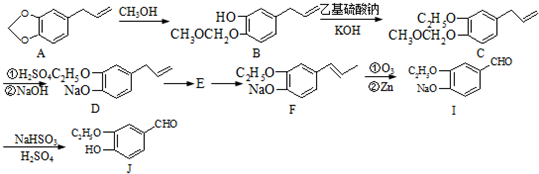
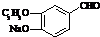 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$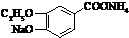 +2Ag↓+3NH3+H2O或
+2Ag↓+3NH3+H2O或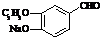 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$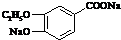 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.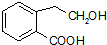 .
. 合成
合成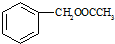 合成路线流程图示例如下:
合成路线流程图示例如下: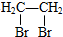
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com