
【题目】密闭容器中盛有1 mol PCl5,加热到200℃时发生了反应:PCl5(g) ![]() PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2 mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是( )
PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2 mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是( )
A. M>N B. M<N C. M=N D. 无法确定
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】自催化作用是指反应物之一使该 反应速率加快的作用。用稀硫酸酸化的![]() 进行下列三组实验,一段时间后溶液均褪色(
进行下列三组实验,一段时间后溶液均褪色(![]() 可以记做
可以记做![]() )。
)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,![]() 是还原剂,产物MnSO4能起自催化作用
是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用![]() 的
的![]() 做实验①,推测比实验①褪色快
做实验①,推测比实验①褪色快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)龚老师在大学时候以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OHClO+Cl+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为_____;实验中控制温度除用冰水浴外,还需采取的措施是_______。
(2)步骤Ⅱ合成N2H4·H2O的装置如图所示。

NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是_________;使用冷凝管的目的是_____。
(3)紧接着龚老师查阅资料发现AgSCN为白色难溶物,Ag+可以氧化SCNˉ和Fe2+。为探究SCNˉ和Fe2+的还原性强弱,该同学设计了下图实验装置并进行下列实验。

先断开电键K,向溶液X中滴加0.1mol·L-1KSCN溶液,无明显现象,说明___________________;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____,溶液变红的原因是__________________(用离子方程式表示),该实验设计的优点是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列体系中指定微粒或化学键的数目一定为NA的是
A. 46.0 g乙醇与过量冰醋酸在浓硫酸加热条件下反应所得乙酸乙酯分子
B. 36.0 gCaO2与足量水完全反应过程中转移的电子
C. 53.5 g氯化铵固体溶于氨水所得中性溶液中的NH4+
D. 5.0 g乙烷中所含的共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol·L-lNaCl溶液和10 mL 0.1 mol·L-lK2CrO4溶液中分别滴加0.1 mol·L-lAgNO3溶液。滴加过程中pM[-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是
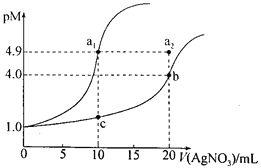
A. 该温度下,Ksp(Ag2CrO4)=4×10-12
B. al、b、c三点所示溶液中c(Ag+):al>b>c
C. 若将上述NaCl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点
D. 用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究不同条件对相同体积相同物质的量浓度的 H2O2分解速率的影响,得到如下数据。由此不能得出的结论是:
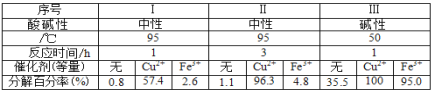
A. Cu2+与 Fe3+对 H2O2 分解都有催化作用,但 Cu2+催化效果更好
B. 由Ⅰ与Ⅱ可知其它条件相同时,时间越长, H2O2 分解越彻底
C. 由Ⅰ与Ⅲ可知其它条件相同时,温度越高, H2O2 分解越快
D. 由Ⅰ与Ⅲ可知其它条件相同时,碱性越强, H2O2 分解越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种合成香料的中间体。其合成路线如下:
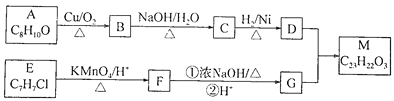
已知:①有机化合物A~M均为芳香族化合物,B能发生银镜反应,E的核磁共振氢谱有3组峰,D与G通过酯化反应合成M。
②![]()
③2RCH2CHO![]()
回答下列问题:
(1)A所含官能团的名称为________,F→G反应①的反应类型为________,M的结构简式为________。
(2)E的名称是________;E→F与F→G的顺序不能颠倒,原因是________。
(3)G的同分异构体中,遇FeCl3溶液显紫色且能发生银镜反应的有________种,其中苯环上的一氯代物只有2种且能发生水解反应的是________(填结构简式)。
(4)参照上述合成路线,以CH3CH2OH为原料(无机试剂任用),设计制备CH3CH2CH2CH2OH的合成路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HNO2的电离平衡常数为K=4.6×10-4(已知![]() =2.14),向20 mL 0.01 mol·L-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是
=2.14),向20 mL 0.01 mol·L-1HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是
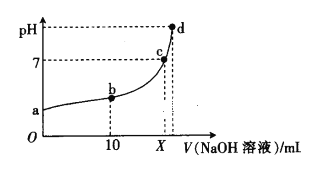
A. X=20
B. a点溶液中c(H+)=2.14×10-3 mol·L-1
C. a、b、c、d四点对应的溶液中水的电离程度逐渐减小
D. b点溶液中微粒浓度的大小关系为c(HNO2)>c(Na+)>c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是

A. 气体A是NO2
B. X溶液中肯定存在Fe2+、Al3+、NH4+、SO42-
C. 溶液E和气体F不能发生化学反应
D. X溶液中不能确定的离子是Al3+和Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com