
【题目】下列有关金属的工业制法中,正确的是![]()
![]()
A. 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
B. 制铁:以铁矿石为原料,用焦炭和空气反应生成CO在高温下还原铁矿石中的铁
C. 制镁:用海水为原料,经一系列过程制得氧化镁固体,电解熔融的氧化镁得镁
D. 制钛:用金属钠置换![]() 溶液中的钛
溶液中的钛
科目:高中化学 来源: 题型:
【题目】根据键能数据(H—Cl 431 kJ/mol,H—I 297 kJ/mol),可得出的结论是 ( )
A. 溶于水时,HI比HCl更容易电离,所以氢碘酸是强酸
B. HI比HCl熔、沸点高
C. HI比HCl稳定
D. 拆开等物质的量的HI和HCl,HI消耗的能量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2为红棕色气体,可在火箭燃料中作氧化剂。回答下列问题:
(1)火箭用N2H4和NO2作燃料,产物绿色无污染,该反应的化学方程式为____________。
(2)为探究NO2和铁粉反应的产物,某小组按下图所示装置进行实验。
已知:①二者反应可能的还原产物为N2或NO
②沸点:NO2(21℃),NO(-152℃)
③酸性KMnO4溶液能氧化NO生成NO3-
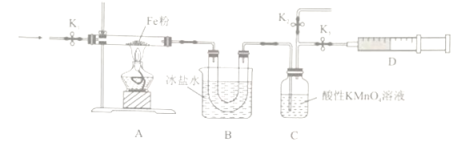
①按上图所示组装完实验仪器后,下一步操作为______________________________。
②实验前需利用气体X将装置的空气排净,气体X可以为_______(填标号)。
A.Ar B.H2 C.CO D.NO2
③排净空气后,后续实验的最佳操作顺序是___c、b(填标号)。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.打开K1和K2,关闭K3,缓缓通入气体X
d.打开K1和K3,关闭K2,缓缓通入NO2 e.关闭K1,停止通入NO2
④装置B的作用是__________________________________。
(3)分析NO2和铁粉反应的产物
①实验过程中A、C装置的物质均无明显颜色变化,D收集到无色气体。由此可推知气体产物为____________________________。
②取少量固体产物于试管,先加入盐酸充分溶解,再加入KSCN溶液,溶液若无血红色,则产物不含三价铁。该方案是否可行并说明理由:_______________________________。
③实验得到的相关数据如下表:
玻璃管质量/g | Fe质量/g | 反应后(玻璃管+固体)/g |
m | 1.12 | m+1.52 |
综合实验现象和计算可知,固体生成物一定有______(填“FeO”Fe2O3”或“Fe3O4”);反应的方程式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+,下列说法正确的是

A. 放电时,右槽发生还原反应
B. 放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O
C. 充电时,每转移1mol电子,n(H+)的变化量为1mol
D. 充电时,阴极电解液pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g) ![]() r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是( )
r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是( )
A.T1>T2 , p1>p2 , m+n>r,正反应吸热
B.T1<T2 , p1<p2 , m+n<r,正反应吸热
C.T1>T2 , p1>p2 , m+n<r,正反应放热
D.T1<T2 , p1<p2 , m+n>r,正反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:
![]() 取一定量的该烃,使其充分燃烧后的气体通过干燥管,干燥管增重
取一定量的该烃,使其充分燃烧后的气体通过干燥管,干燥管增重![]() ;再通过石灰水,石灰水增重
;再通过石灰水,石灰水增重![]() 。
。
![]() 经测定,该烃(气体)
经测定,该烃(气体)![]() 在标准状况下的密度为
在标准状况下的密度为![]() 。
。
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
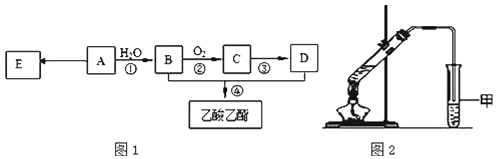
(1)![]() 该烃A能与______g溴发生加成反应;加成产物需______mol溴蒸气完全取代;
该烃A能与______g溴发生加成反应;加成产物需______mol溴蒸气完全取代;
(2)B中官能团的名称是_________,B通过两次氧化可得到D,也可通过加入的氧化试剂为______![]() 任填一种
任填一种![]() 直接氧化为D.
直接氧化为D.
(3)E是常见的高分子材料,写出E的结构简式__________;合成E的反应类型_______________;
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是__________________;
②上述实验中饱和碳酸钠溶液的作用是__________________![]() 填字母
填字母![]() ;
;
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.降低乙酸乙酯在水中的溶解度,有利于分层析出
D.加速酯的生成,提高其产率
![]() 在实验室利用B和D制备乙酸乙酯的实验中,若用1molB和1molD充分反应,不能生成1mol乙酸乙酯,原因是______________________________.
在实验室利用B和D制备乙酸乙酯的实验中,若用1molB和1molD充分反应,不能生成1mol乙酸乙酯,原因是______________________________.
(5)与乙酸乙酯互为同分异构体且能与![]() 反应生成CO2的有机物的结构简式为:
反应生成CO2的有机物的结构简式为:
________________、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事故的处理方法正确的是( )
A.不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦
B.实验桌上的酒精灯倾倒了燃烧起来,应立即用湿布扑灭
C.皮肤上溅有较多的浓硫酸,应立即用水冲洗
D.配制硫酸溶液时,可先在量筒中加入一定体积水,再在搅拌条件下慢慢加入浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金刚石的晶体中,含有由共价键形成的碳原子环,其中最小的环上所需碳原子数及每个碳原子上任意两个C--C键间的夹角是( )
A.6个120° B.5个108° C.4个109°28′ D.6个109°28′
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠的化学性质叙述:①钠与水剧烈反应生成氢氧化钠和氢气;②钠在空气中燃烧时生成白色固体过氧化钠;③钠与盐酸反应时先与酸反应,过量的钠再与水反应;④钠是金属,不溶于水也不和水反应;⑤钠可从硫酸铜溶液中置换出铜。正确的是( )
A.④⑤B.②③C.①②D.①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com