
【题目】下列离子方程式正确的是
A.氨水中通入过量的SO2:2NH3·H2O + SO2 = 2NH4+ + SO32-+H2O
B.大理石与醋酸反应:CaCO3+2H+ =Ca2+ + H2O + CO2↑
C.向热的稀硫酸中加入铜粉并鼓入空气:2Cu+4H++O2![]() 2Cu2++2H2O
2Cu2++2H2O
D.碳酸氢钠溶液和过量氢氧化钡溶液混合:2HCO3-+ Ba2+ + 2OH-== BaCO3↓+ CO32- + 2H2O
【答案】C
【解析】
A项、氨水与过量的SO2反应生成亚硫酸氢铵,反应的离子方程式为NH3·H2O + SO2 =NH4+ + HSO3-,故A错误;
B项、大理石的主要成分是碳酸钙,碳酸钙与醋酸溶液反应生成醋酸钙、二氧化碳和水,醋酸是弱酸,不能拆写,反应的离子方程式为CaCO3 +2CH3COOH= Ca2++2CH3COO—+H2O +CO2↑,故B错误;
C项、热的稀硫酸中加入铜粉,鼓入空气后反应生成硫酸铜和水,反应的离子方程式为2Cu+4H++O2![]() 2Cu2++2H2O,故C正确;
2Cu2++2H2O,故C正确;
D项、碳酸氢钠溶液和过量氢氧化钡溶液反应生成碳酸钡沉淀、氢氧化钠和水,反应的离子方程式为HCO3-+ Ba2+ + OH-== BaCO3↓+ H2O,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】25℃时,分别向浓度均为0.1 mol/L,体积均为20 mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是
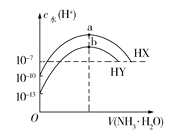
A. HX的电离方程式为HX![]() H++X
H++X
B. b点时溶液中c(![]() )=c(Y)>c(H+)=c(OH)
)=c(Y)>c(H+)=c(OH)
C. HX的电离平衡常数约为1×107 mol/L
D. a、b两点对应溶液中存在的微粒种类数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物,氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac +CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①写出铜原子的价电子轨道表示式_________。
②氨分子的空间构型为_________;氨气极易溶于水是因为_________;氨水中各元素原子的电负性从大到小排列顺序为_________。
③醋酸分子中,碳原子的杂化方式是___________。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有_________。
a 离子键b 配位键c σ键d π键
(2)某离子型氢化物化学式为XY2,晶胞结构如图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
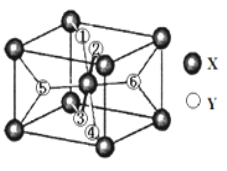
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞__________。(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是_______。
a XY2晶体>硅烷晶体>固态氨 b XY2晶体>固态氨>硅烷晶体
c 固态氨>硅烷晶体>XY2晶体 d 硅烷晶体>固态氨>XY2晶体
(3)MgH2是金属氢化物储氢材料,其晶胞如下图所示,该晶体的密度为agcm-3,则晶胞的体积为___________cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。
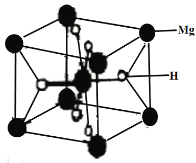
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一种利用原电池原理设计测定O2含量的气体传感器示意图,RbAg4I5是只能传导Ag+的固体电解质。O2可以通过聚四氟乙烯膜与AlI3 反应生成Al2O 3和I2,通过电池电位计的变化可以测得O2的含量。下列说法正确的是( )

A. 正极反应为:3O2+12e-+4Al3+=2Al2O3
B. 传感器总反应为:3O2+4AlI3+12Ag=2Al2O3+12AgI
C. 外电路转移0.01mol电子,消耗O2的体积为0.56L
D. 给传感器充电时,Ag+向多孔石墨电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,有机化合物 Y 可发生重排反应:
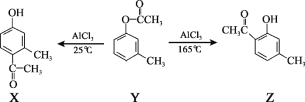
下列说法不正确的是( )
A.X、Y、Z互为同分异构体
B.1 mol X最多能与3 mol H2发生加成反应
C.1 mol Y最多能与2 mol NaOH发生反应
D.通过调控温度可以得到不同的目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiS 可用作陶瓷和搪瓷的着色剂。NiS 在有水存在时能被氧气氧化成Ni(OH)S。将H2S通入稀硫酸酸化的NiSO4溶液中,经过过滤,制得NiS 沉淀,装置如图所示:

下列对实验的叙述正确的是
A. 在装置A中滴加蒸馏水前通入N2,是为了将H2S赶入C 装置中与NiSO4溶液反应
B. 装置B 中盛放浓硫酸
C. 装置D 中的洗涤液应用煮沸过的蒸馏水
D. 反应结束后继续通入N2 可将C装置中产生的沉淀压入过滤沉淀漏斗中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,有机化合物 Y 可发生重排反应:
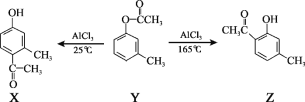
下列说法不正确的是( )
A.X、Y、Z互为同分异构体
B.1 mol X最多能与3 mol H2发生加成反应
C.1 mol Y最多能与2 mol NaOH发生反应
D.通过调控温度可以得到不同的目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如下图所示:用离子方程式表示海水呈弱碱性的原因_________。己知春季海水pH=8.1,预测夏季海水碱性将会_________(填写“增强”或“减弱”),理由是________(写出1条即可)
无机碳 | HCO3- | 90% |
CO32- | 9% | |
CO2 | 1% | |
H2CO3 | ||
其中H2CO3仅为CO2的0.2% | ||
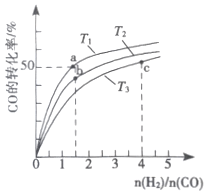
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g) ![]() CH3OH(g) △H<0,在容积为1L 的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的 起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是_________(a、b点横坐标相同,a在曲线T1上,b在曲线T2上)
CH3OH(g) △H<0,在容积为1L 的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的 起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是_________(a、b点横坐标相同,a在曲线T1上,b在曲线T2上)
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点(1.5,50)状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
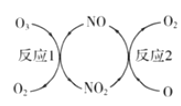
①NO的作用是__________________。
②己知:O3(g)+O(g)=2O2(g) △H =-143kJ·mol-1
反应 1: O3(g)+NO(g) ![]() NO2(g)+O2(g) △H1=-200.2kJ·mol-1
NO2(g)+O2(g) △H1=-200.2kJ·mol-1
反应2:热化学方程式为______________________。
(4)近年来,地下水中的氮污染己成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用 下,密闭容器中的H2可髙效转化酸性溶液中的硝态氮(NO3-)从而降低水体中的氮含量,其工作原理如下图所示
①Ir表面发生反应的方程式为__________________________。
②若导电基体上的Pt颗粒增多,造成的后果是__________________________。

(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示,甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨II附近发生的电极反应式为__________________________。
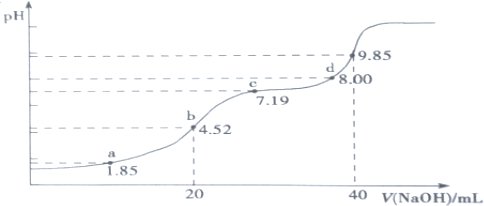
(6)大气污染物SO 2可用NaOH吸收。已知pKa=-lgKa,25℃时,H2SO3 的 pKa1=1.85, pKa2=7.19。该温度下用 0.1mol·L-1NaOH溶液滴定 20mL0.1mol·L-1H2SO3溶液的滴定曲线如下图所示。b点所得溶液中各离子浓度由大到小的顺序是__________________________;c点所得溶液中:c(Na+)__________3c(HSO3-)(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 是两种主要的温室气体,以
是两种主要的温室气体,以![]() 和
和![]() 为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
为原料制造更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
(1)工业上![]() 催化重整是目前大规模制取合成气(CO和H2混合气称为合成气)的重要方法,其原理为:
催化重整是目前大规模制取合成气(CO和H2混合气称为合成气)的重要方法,其原理为:
反应Ⅰ:![]() ;
;![]()
反应Ⅱ:![]() ;
;![]()
![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 的热化学方程式是___________________。
的热化学方程式是___________________。
(2)将1 mol ![]() 和1 mol
和1 mol ![]() 加入恒温恒压的密闭容器中(温度298K、压强100kPa),发生反应Ⅰ,不考虑反应Ⅱ的发生,该反应中,正反应速率
加入恒温恒压的密闭容器中(温度298K、压强100kPa),发生反应Ⅰ,不考虑反应Ⅱ的发生,该反应中,正反应速率![]() ,p为分压(分压=总压×物质的量分数),若该条件下
,p为分压(分压=总压×物质的量分数),若该条件下![]() ,当
,当![]() 分解20%时,
分解20%时,![]() __________kPas-1。
__________kPas-1。
(3)将![]() 和
和![]() 在一定条件下反应可制得合成气,在1 L密闭容器中通入
在一定条件下反应可制得合成气,在1 L密闭容器中通入![]() 与
与![]() ,使其物质的量浓度均为
,使其物质的量浓度均为![]() ,在一定条件下发生反应:
,在一定条件下发生反应:,测得CH4的平衡转化率与温度及压强的关系如下图所示:
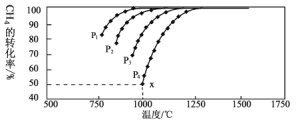
①压强![]() 、
、![]() 、
、![]() 、
、![]() 由小到大的关系为_________。
由小到大的关系为_________。
②对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作![]() ),如果
),如果![]() ,求x点的平衡常数
,求x点的平衡常数![]() ________________(用平衡分压代替平衡浓度计算)。
________________(用平衡分压代替平衡浓度计算)。
③下列措施中能使平衡正向移动的是___________(填字母)。
a.升高温度
b.增大压强
c.保持温度、压强不变,充入He
d.恒温、恒容,再充入1 mol ![]() 和1 mol
和1 mol ![]()
(4)科学家还研究了其他转化温室气体的方法,利用图所示装置可以将![]() 转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,M为_________极(填“正”或“负”),导线中通过2 mol电子后,假定体积不变M极电解质溶液的pH__________(填“增大”、“减小”或“不变”),N极电解质溶液变化的质量
转化为气体燃料CO(电解质溶液为稀硫酸),该装置工作时,M为_________极(填“正”或“负”),导线中通过2 mol电子后,假定体积不变M极电解质溶液的pH__________(填“增大”、“减小”或“不变”),N极电解质溶液变化的质量![]() __________g。
__________g。
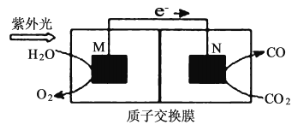
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com