
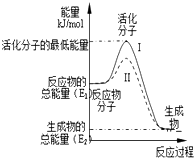
 (1)已知:
(1)已知:分析 (1)①Fe(s)+$\frac{1}{2}$O2(g)═FeO(s)△H1=-272.0kJ•mol-1;
②2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H2=-1675.7kJ•mol-1;
依据盖斯定律计算②-①×3计算;
(2)①依据图象分析反应物的能量大于生成物的能量,反应放热;在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应,反应需要能量;反应的焓变=生成物的能量-反应物的能量;
②反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;
③对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,结合影响所以速率的元素分析判断.
解答 解:(1)①Fe(s)+$\frac{1}{2}$O2(g)═FeO(s)△H1=-272.0kJ•mol-1;
②2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H2=-1675.7kJ•mol-1;
依据盖斯定律计算②-①×3得到:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7KJ/mol;
故答案为:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7KJ/mol;
(2)①依据图象分析反应物的能量大于生成物的能量,反应放热;在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应,反应需要能量;反应的焓变=生成物的能量-反应物的能量,即△H=(E2-E1)kJ•mol-1,
故答案为:放热;(E2-E1)kJ•mol-1;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,该反应的活化能为167.2kJ•mol-1,则其逆反应的活化能=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol,
故答案为:409.0KJ/mol;
(3)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,化学反应速率影响因素中,催化剂有此作用,所以最有可能使用了催化剂,故答案为:使用了催化剂.
点评 本题考查了热化学方程式书写和盖斯定律计算以及化学反应的能量变化与反应的焓变关系的分析判断,反应活化能的判断计算,图象的综合应用,题目难度不大,读懂图象,焓变和活化能计算方法的理解是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 保存浓硝酸时,通常用棕色瓶并放在阴凉处 | |
| B. | 用锌与硫酸反应制取氢气时,适当增大硫酸溶液的浓度 | |
| C. | 合成氨的反应中,选择“铁触媒”作催化剂 | |
| D. | 在试管中进行铝和氢氧化钠溶液反应时,稍微加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金刚石比石墨稳定 | B. | 1mol石墨比1mol金刚石的总能量低 | ||
| C. | 石墨比金刚石稳定 | D. | 1mol石墨比1mol金刚石的总能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
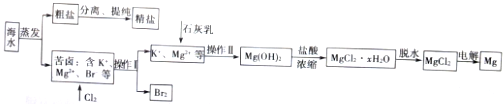
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 反应aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2__T3( )
反应aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2__T3( )| A. | > | B. | = | ||
| C. | < | D. | 条件不足,无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com