
工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下,对下述流程中的判断正确的是:
| A.试剂X为稀硫酸,沉淀中含有硅的化合物 |
| B.反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
| C.结合质子(H+)的能力由弱到强的顺序是OH->CO32->AlO2- |
| D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
B
解析试题分析:A、Al2O3、Fe2O3和硫酸反应,SiO2和硫酸不反应,要将氧化铝和其他两种分离出来,应该选择氢氧化钠,将氧化铝溶解为偏铝酸钠,则固体难溶物是氧化铁和二氧化硅,即试剂X为氢氧化钠,沉淀中含有二氧化硅和氧化铁,故A错误;
B、铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)中加入过量的氢氧化钠以后会生成偏铝酸钠溶液,偏铝酸盐中通二氧化碳来获得氢氧化铝沉淀,即CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故B正确;
C、结合质子的能力就是指碱性,结合质子能力越强,相应的酸放出质子的能力就越弱,其对应的酸的酸性就越弱,显然酸性强弱HCO3->Al(OH)3>H2O,碱性:OH->AlO2->CO32-,所以结合质子能力:OH->AlO2->CO32-,故C错误;
D、氯化铝是分子晶体,熔融时不存在铝离子,电解熔融的氯化铝不能获得金属铝,故D错误.
故选B。
考点:考查制备实验方案的设计、金属的冶炼等。


科目:高中化学 来源: 题型:实验题
胆矾(CuSO4·5H2O)是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。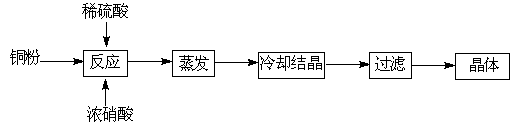
完成下列各题:
Ⅰ.(1)向含铜粉的稀硫酸中滴加浓硝酸,随着铜粉的溶解可能观察到的实验现象 、 。
(2)制得的胆矾晶体(CuSO4·5H2O)中可能存在的杂质是 (写化学式)。
(3)采用重量法测定CuSO4·5H2O的含量时,步骤如下:
①取样,称量 ②加水溶解 ③加氯化钡溶液生成沉淀 ④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是 。
Ⅱ. 某研究性学习小组用ZRY-1型热重分析仪对12.5克硫酸铜晶体(CuSO4·5H2O)进行热重分析,随温度的升高,硫酸铜晶体依次发生下列反应。
a.CuSO4·5H2O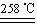 CuSO4+5H2O
CuSO4+5H2O
b.CuSO4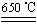 CuO+SO3↑,2SO3
CuO+SO3↑,2SO3 2SO2+O2
2SO2+O2
c.4CuO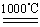 2Cu 2 O+O2↑
2Cu 2 O+O2↑
请回答下列问题:
(1)实验过程中热重分析仪测得残留固体质量为3.8 g,试推断该固体的组分是 (写化学式),其对应的物质的量之比是 。
(2)热重分析仪加热晶体至恒重后,将全部气体导出,通入氢氧化钡溶液充分反应,所得沉淀经过滤、洗涤、干燥,质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下: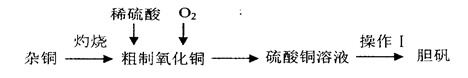
(1)操作I具体为__________、___________、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是___________(填字母代号)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量_______________(填化学式,下同),调节pH至4,生成_________沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。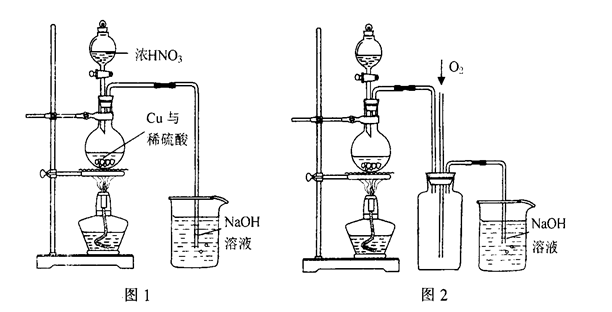
烧瓶内发生反应的离子方程式为____________________________________________;
图2是图1的改进装置,其优点有①__________________________,②_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
在没有现成的CO2气体发生器的情况下,请你选用下图所示部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。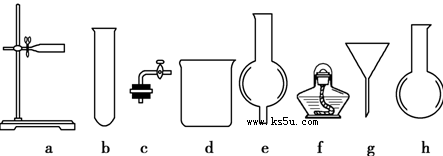
(1)应选用的仪器是________________(填入编号);
(2)若用上述装置制取CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状纯碱、块状大理石,比较合理的方案,应选用的药品是________ _________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关实验操作,现象和结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将过量CO2通入CaCl2溶液中 | 无白色沉淀 | 生成Ca(HCO3)2溶于水 |
| B | 常温下将Al片插入浓硫酸中 | 无明显现象 | Al片和浓硫酸不反应 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| D | 将SO2通入溴水中 | 溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
仅用下表提供的仪器和药品,就能达到相应实验目的的是、
| 编号 | 仪器 | 药品 | 实验目的 |
| A | 托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒 | NaCl固体、蒸馏水 | 配制一定质量份数的NaCl溶液 |
| B | 分液漏斗、烧瓶、锥形瓶、导管及橡皮塞 | 盐酸、大理石、碳酸钠溶液 | 证明非金属性:Cl>C>Si |
| C | 酸式滴定管、胶头滴管、铁架台(带铁夹) | 已知浓度的盐酸、待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
| D | 烧杯、分液漏斗、胶头滴管、铁架台 | 待提纯的AlCl3溶液,NaoH溶液 | 提纯混有MgCl2杂质的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某学生用质量为a g、边长为b cm的正方形镀锌铁片与过量盐酸反应测定镀层厚度,并将实验结果绘图示意,反应完毕后铁片质量为c g(已知锌的密度为ρ g/cm3)。下列叙述错误的是
| A.t1时刻锌镀层已完全反应 |
B.锌镀层的厚度为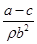 |
| C.反应放热也是影响OA段的反应速率的因素之一 |
| D.有原电池反应发生,正极的电极反应式为Zn - 2e → Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验操作正确且能达到预期目的的是( )
| | 实验目的 | 操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| ④ | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| ⑤ | 比较确定铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| ⑥ | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验对应的结论不正确的是( )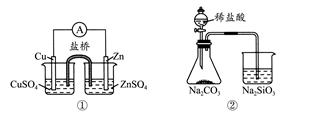
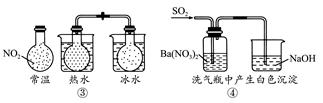
| A.①能组成Zn-Cu原电池 |
| B.②能证明非金属性Cl>C>Si |
C.③说明反应2NO2(g)  N2O4(g),ΔH<0 N2O4(g),ΔH<0 |
| D.④白色沉淀为BaSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com