
甲、乙、丙、丁四种金属,仅甲在自然界主要以游离态存在,丙盐的水溶液不能用丁制 的容器盛放;丁与乙盐的水溶液不反应。则这四种金属的活动性由强到弱的顺序可能是( )
的容器盛放;丁与乙盐的水溶液不反应。则这四种金属的活动性由强到弱的顺序可能是( )
A.甲乙丙丁 B.丁乙丙甲 C.丙乙丁甲 D.乙丁丙甲
科目:高中化学 来源:2016-2017学年辽宁省沈阳市城郊市重点联合体高一上期中化学卷(解析版) 题型:选择题
下列各组物质的稀溶液,不用其他试剂就能一一区别开来的是( )
①Na2SO4、BaCl2、K2CO3、KNO3
②NaCl、AgNO3、Na2CO3、CaCl2
③CuSO4、BaCl2、NaOH、NaCl
④MgSO4、Na2CO3、Ba(NO3)2、H2SO4
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市等五校高一上联考二化学试卷(解析版) 题型:填空题
围绕下列七种物质:①铝,②NaHCO3溶液,③稀硝酸,④H2SO4,⑤熔融Ba(OH)2 ,⑥NaOH溶液,⑦A12(SO4)3固体 ,根据要求回答下列问题。
(1)既能与强酸反应,又能与强碱反应的是 (填序号)。
(2)属于电解质的是 (填序号)。
(3)写出①和⑥反应的离子方程式 。
(4)34.2g⑦溶于水配成500mL溶液,溶液中SO42-的物质的量浓度为 。
(5)①与③发生反应的化学方程式为A1+4HNO3=A1(NO3)3+NO↑+2H2O,该反应中还原剂与氧化剂的 物质的量之比是 。
物质的量之比是 。
(6)除去②中的Na2CO3,相关的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市等五校高一上联考二化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是( )
A.在H2SO4溶液中滴入Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
D.醋酸溶解鸡蛋壳:CaCO3+2H+=Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上学期期中化学试卷(解析版) 题型:填空题
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)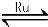 CH4(g)+2H2O(g) △H﹤0
CH4(g)+2H2O(g) △H﹤0
则升高温度平衡体系中H2的体积分数将___________;(选填“增大”、“减小”或“不变”)
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。
(3)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3- H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。____________________
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。____________________
(4)查阅资料获知如下信息:
i.H2CO3:Ki1=4.3×10-7,Ki2=5.6×10-11(以Ki1为主)
ii.标况下,CO2的溶解度为约为1:1
iii.H2O+CO2  H2CO3
H2CO3 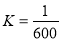
iv. 

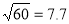 ㏒(6)=0.8
㏒(6)=0.8
请尝试估算:
①饱和二氧化碳溶液中碳酸的物质的量浓度c(H2CO3)约为_______________mol/L;
②饱和二氧化碳溶液中碳酸的电离度α约为_____________。
③正常雨水的pH约为____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上学期期中化学试卷(解析版) 题型:选择题
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随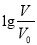 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
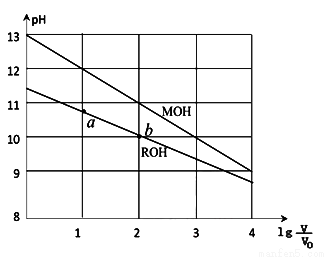
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当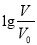 =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则  增大
增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高一上期中化学卷(解析版) 题型:填空题
(1)已知氯气通入热的苛性钠溶液中会发生如下反应:
3Cl2+6NaOH=5NaCl+ NaClO3+3H2O
①反应中还原剂是____________(填化学式);
②把此反应改写成离子方程式:______________________;
③若消耗106.5gCl2,则生成的氧化产物的物质的量是____________________ 。
(2)用“双线桥”表示下列氧化还原反应中电子转移的方向和数目:
3Cl2+6NaOH=5NaCl+ NaClO3+3H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上期中化学卷(解析版) 题型:选择题
强酸和强碱稀溶液的中和热可表示为
H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3kJ/mol
①HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l) △H=﹣akJ/mol
②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l) △H=﹣bkJ/mol
③Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l) △H=﹣ckJ/mol
则a,b,c三者的大小关系判断错误的是( )
A.c>114.6 B.a<57.3 C.b>57.3 D.2a=2b=c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com