
有pH为13的Ba(OH)2、NaOH的混合溶液100 mL,从中取出25 mL用0.025 mol/L H2SO4滴定,当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半。求:原混合溶液中Ba(OH)2的物质的量浓度
Ba(OH)2+H2SO4=BaSO4↓+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点时所消耗酸体积的一半。 说明2个反应消耗的H2SO4的体积是一样的,也就是物质的量是一样的所以它们的物质的量浓度比为1:2
因为pH=13,所以2n(Ba(OH)2)+n(NaOH)="0.01mol"
所以n(Ba(OH)2)=0.0025mol,n(NaOH)="0.005mol" C(Ba(OH)2)="0.0025" mol/0.1L="0.025" mol/L
解析试题分析:加入硫酸后发生两个反应:Ba(OH)2+H2SO4=BaSO4↓+2H2O 、2NaOH+H2SO4=Na2SO4+2H2O ,当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点时所消耗酸体积的一半。说明2个反应消耗的H2SO4的体积相同,根据化学方程式可知Ba(OH)2与NaOH的物质的量之比为1:2,即二者物质的量浓度之比为1:2,因为混合溶液的pH为13,可得OH?浓度为0.1mol?L?1,进而求出Ba(OH)2的浓度。
考点:本题考查化学计算。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:填空题
(9分)某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下: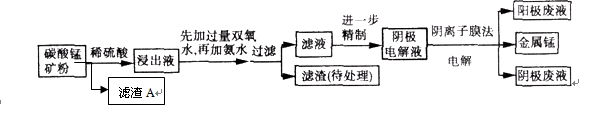
阴离子膜法电解装置如下图所示: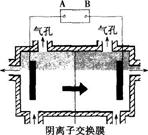
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式: 。
(2)已知Ksp (Fe(OH)3) =" 4" ´10–38,假设溶液中Fe3+离子浓度为0.1 mol·L–1,则开始生成Fe(OH)3沉淀的pH是_________,沉淀完全的pH是_________。(可能用到的数据:lg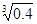 = -0.1 lg
= -0.1 lg =0.2)
=0.2)
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 1.2 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在80℃时,将0.8mol的A气体充入4L已抽空的固定容积的密闭容器中发生反应:A(g) mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)目前,全世界的镍消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大的潜力。镍化合物中的三氧化二镍是一种重要的电子元件材料和二次电池材料。工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍,然后高温煅烧草酸镍来制取三氧化二镍。
已知:①草酸的钙、镁、镍盐均难溶于水,且溶解度:NiC2O4> NiC2O4·H2O> NiC2O4·2H2O
②常温下,Ksp[(Fe(OH))3]=4.0×10-38,lg5=0.7
根据下列工艺流程图回答问题:
(1)加6%的H2O2时,温度不能太高,其目的是 。若H2O2在一开始酸溶时便与盐酸一起加入,会造成酸溶过滤后的滤液中增加一种金属离子,用离子方程式表示这一情况 。
(2)流程中有一步是调pH,使Fe3+转化为Fe(OH)3沉淀,常温下当溶液中c (Fe3+)=0.5×10-5mol/L时,溶液的pH= 。
(3)流程中加入NH4F的目的是 。
(4)将最后所得的草酸镍晶体在空气中强热到400℃,可生成三氧化二镍和无毒气体,写出该反应的化学方程式 。
(5)工业上还可用电解法制取三氧化二镍,用NaOH溶液调节NiCl2溶液的pH至7.5,再加入适量Na2SO4进行电解,电解产生的Cl2其80%的可将二价镍氧化为三价镍。写出Cl2氧化Ni(OH)2生成三氧化二镍的离子方程式 ;将amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是 。
(6)近年来镍氢电池发展很快,它可由NiO(OH)跟LaNi5H6(LaNi5H6中各元素化合价均可看作是零)组成:6NiO(OH)+LaNi5H6 LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物
(1)提出假设
猜想①:白色不溶物可能为___
猜想②:白色不溶物可能为MgCO3
猜想③:白色不溶物可能是碱式碳酸镁
(2)定性实验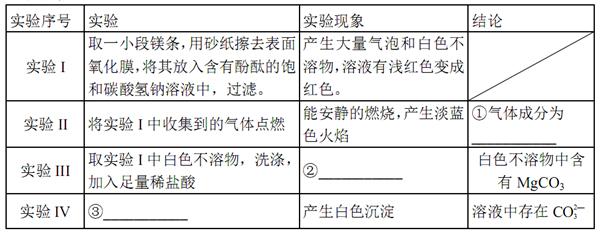
(3)定量实验:
称取实验I中所得干燥、纯净的白色不溶物14.2 g,充分加热至不在产生气体为止,并使分解
产生的气体全部通入如下装置中: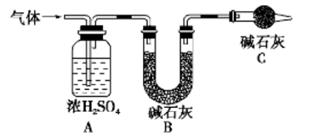
①实验测得装置A增重1.8 g,装置B增重4.4 g,则白色不溶物的化学式为_____
②装置C的作用为____,若移除装置C会导致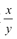 的值___(填“偏大”、“偏小”或“不变”
的值___(填“偏大”、“偏小”或“不变”
(4)探究原理
①请结合化学用语和化学平衡移动原理解释Mg与饱和NaHC03溶液反应产生大量气泡和白
色不溶物的原因:_______
②250C时,测得Mg与饱和NaHC03溶液反应所得混合体系的pH为10,则该体系中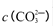
为(已知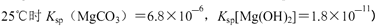
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在20mL 0.0025mol·L-1 AgNO3溶液中,加入5mL 0.01mol·L-1 KCl溶液,通过计算判断是否有AgCl沉淀生成。已知Ksp(AgCl)=1.8×10-10 (混合后溶液的总体积为两者体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(―)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是 。
(2)阴极附近溶液pH升高的原因是_ (用电极反应式解释);溶液中同时生成的沉淀还有 。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在400℃以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下: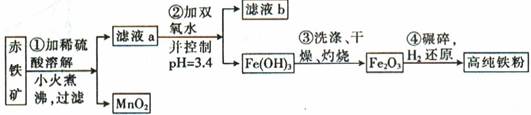
已知①某赤铁矿石含60.0%Fe2O3、3.6%FeO,还含有Al2O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:
(3)步骤②中加双氧水的目的是 ,pH控制在3.4的作用是 ,已知25℃时,Ksp[Cu(OH)2] =2.0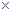 10-20,该温度下反应:Cu2++2H2O
10-20,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。
(4)如何判断步骤③中沉淀是否洗涤干净? 。
(5)制备氮化铁磁粉的反应:Fe+NH3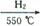 FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。
FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
葡萄糖酸锌[(C6H11O6O)2Zn]是一种营养锌强化剂,对婴儿及青少年的智力和身体发育有重要作用。工业上通过如下两步制备:
(1)步骤一:充分反应后,过滤除去CaSO4沉淀。设计一个简单的实验,检验产物葡萄糖酸溶液中是否含有SO42—: 。
(2)步骤二:将葡萄糖酸溶液与ZnO混合,使其充分反应后,继续加入葡萄糖酸溶液至pH为5.8,其目的是 ,下列物质可替代ZnO的是 (填字母)。
a.NH3·H2O b.Zn(OH)2 c.NaOH d.ZnSO4
(3)将最后所得溶液浓缩至原来体积的 ,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是 。
,加入适量无水乙醇,放置8h以上,经结晶、分离、干燥获得葡萄糖酸锌晶体。分离过程中加入无水乙醇的目的是 。
(4)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Fe2+ | 5. 8 | 8. 8 |
| Cu2+ | 5. 2 | 6. 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述是某同学做完铜锌原电池实验后得出的结论和认识,正确的是( )
| A.构成原电池正极和负极的材料必须是两种金属 |
| B.由铜锌作为电极与硫酸铜溶液组成的原电池中,铜是负极 |
| C.电流通过硫酸溶液,SO42- 向正极移动 |
| D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol 电子通过 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com