
含有1.4 g某碱金属及其氧化物的混合物,跟水完全反应后,蒸干溶液得到不含结晶水的固体1.79 g,则该混合物中碱金属元素的质量分数为多少?
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:022
用下图所示的装置测定某碱金属的原子量。仪器连同水及干燥管(内装无水氯化钙)的总质量为480.00 g。将1.40 g某碱金属投入水中,立即用带有干燥管的塞子塞住瓶口。反应完毕,测得整套仪器的质量为481.20 g。
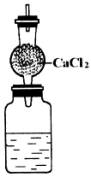
(1)则该碱金属的原子量是________,元素符号是________。
(2)装置中的干燥管的作用是________,若不用无水氯化钙,可改用________。
(3)若不用干燥管,测得的原子量比实际的原子量________(填“大”或“小”),其理由是________。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022

(1)则该碱金属的原子量是________,元素符号是________。
(2)装置中的干燥管的作用是________,若不用无水氯化钙,可改用________。
(3)若不用干燥管,测得的原子量比实际的原子量________(填“大”或“小”),其理由是________。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
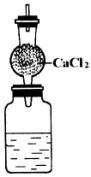
(1)则该碱金属的原子量是________,元素符号是________。
(2)装置中的干燥管的作用是________,若不用无水氯化钙,可改用________。
(3)若不用干燥管,测得的原子量比实际的原子量________(填“大”或“小”),其理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示装置用于测定某碱金属的相对原子质量。仪器本身连同水和干燥管以及其内的无水氯化钙的总质量为480.00 g。现将1.46 g某碱金属单质投入水中,立即用带有干燥管的塞子塞紧瓶口,反应完毕后,测得整套仪器的总质量为481.25 g。该金属元素的相对原子质量是________(结果保留两位小数),若不用干燥管,测得的相对原子质量比实际相对原子质量________(填“偏大”“偏小”或“相等”),理由是________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com