
| A. | CO | B. | NH3 | C. | SO2 | D. | HCl |
分析 酸雨是指溶液pH小于5.6的雨水,正常雨水的pH约为5.6;酸雨主要由化石燃料燃烧产生的二氧化硫、氮氧化物等酸性气体,经过复杂的大气化学反应,被雨水吸收溶解而成,据此分析解答即可.
解答 解:酸雨是指溶液pH小于5.6的雨水,正常雨水的pH约为5.6;酸雨主要由化石燃料燃烧产生的二氧化硫、氮氧化物等酸性气体,经过复杂的大气化学反应,被雨水吸收溶解而成.
A、一氧化碳污染空气,但不是形成酸雨的气体,故A错误;
B、氨气污染空气,溶于水现场一水合氨显碱性,不是形成酸雨的气体,故B错误;
C、二氧化硫经过复杂的大气化学反应,被雨水吸收溶解,能形成酸雨,故C正确;
D、HCl污染空气,不是形成酸雨的气体,故D错误;
故选C.
点评 本题考查了酸雨的形成,完成此题,可以依据已有的知识进行,题目难度不大,酸雨是工业发展出现的副产物,了解酸雨的形成原因是正确解答本题的关键.


科目:高中化学 来源: 题型:实验题
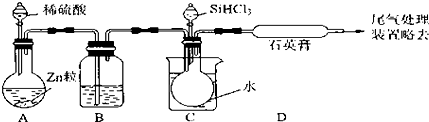
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C
,并写出元素b的单质在二氧化碳中燃烧的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C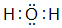 ,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.
,写出f元素单质与该氢化物反应的离子方程式:Cl2+H2O=H++Cl-+HClO.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 两者的分散质微粒均能透过半透膜和滤纸 | |
| C. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现明显的“光亮的通路”,前者则没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和NO | B. | CO和NO | C. | CO2和O2 | D. | 碳氢化合物和O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com