
| A.20mL0.3 mol·L-1Na2CO3 | B.10mL0.4 mol·L-1Na2CO3 |
| C.25mL0.4 mol·L-1Na2CO3 | D.15mL0.5 mol·L-1Na2CO3 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| N2(g)+3H2(g)?2NH3(g) | |||
| N2 | H2 | NH3 | |
| 起始浓度mol/L | 1.0 | 3.0 | 0.2 |
| 2s末浓度mol/L | 0.6 | 1.8 | 1.0 |
| 4s末浓度mol/L | 0.4 | 1.2 | 1.4 |
| A.2s末氨气的反应速率为0.4mol/(L?s) |
| B.前2s时间内氨气的平均反应速率为0.4mol/(L?s) |
| C.前4s时间内氨气的平均反应速率为0.3mol/(L?s) |
| D.2s~4s时间内氨气的平均反应速率为0.2mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
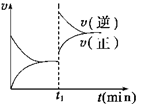
A.2A(g) + B(g) 2C(g) ΔH>0 2C(g) ΔH>0 |
B.2SO2(g)+ O2(g)  2SO3(g)ΔH<0 2SO3(g)ΔH<0 |
C.H2(g) + I2(g)  2HI(g)ΔH>0 2HI(g)ΔH>0 |
D.4NH3(g)+ 5O2(g)  4NO(g) + 6H2O(g)ΔH<0 4NO(g) + 6H2O(g)ΔH<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.增加N2的浓度能加快反应速率 |
| B.降低体系温度能加快反应速率 |
| C.使用催化剂不影响反应速率 |
| D.若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
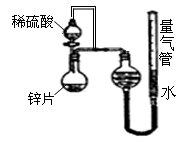
| 序号 | Ⅴ(H2SO4)/mL | C(H2SO4)/mol·L-1 | t/s |
| Ⅰ | 10 | 1 | t1 |
| Ⅱ | 10 | 3 | t2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 R(气)+2L此反应符合下面图象,下列叙述正确的是( )
R(气)+2L此反应符合下面图象,下列叙述正确的是( )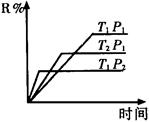
| A.正反应吸热,L是气体 |
| B.正反应吸热,L是固体 |
| C.正反应放热,L是气体 |
| D.正反应放热,L是固体或液体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
| B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
| C |  在容积可变的密闭容器中发生反应:2NH3(g)??N2H4(l)+H2(g),把容积的体积缩小一半 在容积可变的密闭容器中发生反应:2NH3(g)??N2H4(l)+H2(g),把容积的体积缩小一半 | 正反应速率加快,逆反应速率减慢 |
| D | A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com