
【题目】关于苯甲酸的分离、提纯实验,下列说法不正确的是
A. 苯甲酸在水中的溶解度随温度的升高变化很小
B. 趁热过滤的目的是为了除去泥沙,并减少苯甲酸的损失
C. 趁热过滤后将滤液降温可以得到苯甲酸
D. 如果想进一步提纯苯甲酸,可以再次配成热饱和溶液,并降温结晶
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】下列示意图与对应的反应情况正确的是( )

A. 含0.01 mol NaOH和0.01 mol Ba(OH)2的混合溶液中缓慢通入CO2
B. KHCO3溶液中逐滴加入Ba(OH)2溶液
C. KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D. 向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,A是单质,B的焰色反应呈黄色。判断A、B、C、D的化学式:

A_____ B______ C______ D______
下列转化的化学方程式为:
(1)A→B__________
(2)B→D________
(3)A→C__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH标准溶液对某醋酸溶液的浓度进行标定。回答下列问题:
(1)实验用品有:0.2000 mol/L的NaOH溶液,醋酸溶液,蒸馏水;pH计,酸式滴定管,碱式滴定管,锥形瓶,烧杯,铁架台。还缺少的一种仪器是____________。
(2)为标定该醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 19.95 |
该醋酸溶液的准确浓度为_____________(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是_______________。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烯烃、炔烃的叙述中,正确的是
A. 结构简式为CH3CH2CH(CH3)CH(OH)CH3的名称为3-甲基-2-羟基戊醇
B. CH3-CH=CH-C≡C-CF3分子结构中6个碳原子可能都在一条直线上
C. 相同物质的量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的量相同
D. β-月桂烯的结构如图所示(![]() ),该物质与等物质的量溴发生加成反应的产物(不考虑立体异构)理论上最多有4种
),该物质与等物质的量溴发生加成反应的产物(不考虑立体异构)理论上最多有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰与浓盐酸反应的方程式为MnO2+4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O,请用单线桥法表示电子的转移情况,并指出氧化剂、还原剂、氧化产物、还原产物。
MnCl2 + Cl2↑+ 2H2O,请用单线桥法表示电子的转移情况,并指出氧化剂、还原剂、氧化产物、还原产物。
(1)MnO2+4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O_____
MnCl2 + Cl2↑+ 2H2O_____
(2)氧化剂:_____还原剂:_____氧化产物:_____还原产物:_____
(3)每转移电子的数目为6.02×1023个时生成标况下气体的体积为:______L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫和硫化氢都是有毒物质,但它们在工业上都有着重要的用途。请回答下列有关问题:
(1)燃煤脱疏是科研工作者研究的重要课题之一,己知有两种脱硫方法,一是活性炭作化氧化法脱流;二是CO还原法脱硫。
①活性炭在反应过程中作为催化剂,改变了______(填选项字母)。
a.反应限度 b.反应速率 c.反应活化能 d.反应焓变 e.反应路径
②CO还原法的原理是:2CO(g)+SO2(g)![]() S(g)+2CO2(g),△H。
S(g)+2CO2(g),△H。
已知:S(g)+O2(g)=SO2(g),△H1=-574.0kJ/mol,CO的燃烧热为283.0kJ/mol,则△H=___。
③在两个容积为10L的恒容绝热密闭容器中发生反应:
2CO(g)+SO2(g)![]() S(g)+2CO2(g),各起始反应物的物质的量如右表所示,起始温度均为T℃。两容器中平衡常数K甲______K乙(填“>”“=”或“<”),理由是__________。
S(g)+2CO2(g),各起始反应物的物质的量如右表所示,起始温度均为T℃。两容器中平衡常数K甲______K乙(填“>”“=”或“<”),理由是__________。

(2)H2S受热发生分解反应:2H2S(g)=2H2(g)+S2(g),在密闭容器中,充入0.20molH2S(g),压强为p时,控制不同的温度进行实验,H2S的平衡转化率如图所示。

①出强为p,温度为T6℃时,反应经tmin达到平衡,则平均反应速率v(S2)=_______mol/min.
②若压强p=aMPa,温度为T4℃时,该反应的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)H2S废气可用足量烧碱溶液吸收,将吸收后的溶液加入由惰性电极组成的电解池中进行电解,阳极区可生成Sx2-。请写出生成Sx2-的电极反应式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:
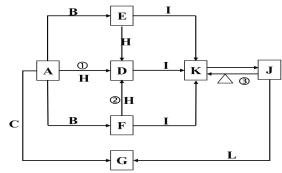
回答下列问题:
(1)A是:_____,C是:_____,L是:______,I是:____(填化学式)。
(2)写出反应①②③的化学反应方程式:
①:____________________________________;
②:____________________________________;
③:____________________________________;
(3)F可作为航天飞船中的供氧剂使用,若要制的氧气含量为25%的空气89.6 L(标况),则需要F的质量为_____g,反应中转移电子的个数为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com