
在2L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间变化如下表:
2NO2(g)体系中,n(NO)随时间变化如下表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。已知:K(300℃)>K(350 ℃),则该反应正反应是 热反应。
(2)图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v(O2)= 。
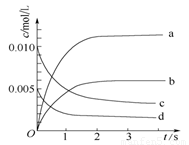
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(1)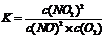 放 (2)b 1.5×10-3
mol/(L·s) (3)bc (4)c
放 (2)b 1.5×10-3
mol/(L·s) (3)bc (4)c
【解析】
试题分析:试题分析:(1)化学平衡常数是可逆反应达到平衡状态时,各生成物浓度幂指数的乘积与个反应物浓度幂指数乘积的比。对于该反应来说,化学平衡常数为 。由于K(300℃)>K(350 ℃),说明升高温度,化学平衡逆向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,逆反应为吸热反应,所以正反应为放热反应。(2)反应开始时,c(NO)=
0.020mol÷2L=0.01mol/L,当反应达到平衡时,c(NO)=
0.007mol÷2L=0.0035mol/L.而NO2开始时浓度为0,达到平衡时,由方程式2NO(g)+O2(g)
。由于K(300℃)>K(350 ℃),说明升高温度,化学平衡逆向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,逆反应为吸热反应,所以正反应为放热反应。(2)反应开始时,c(NO)=
0.020mol÷2L=0.01mol/L,当反应达到平衡时,c(NO)=
0.007mol÷2L=0.0035mol/L.而NO2开始时浓度为0,达到平衡时,由方程式2NO(g)+O2(g) 2NO2(g)中NO与NO2的关系可知b是NO2的变化的曲线。V(NO)= (0.01mol/L-0.004mol/L)÷2s=0.003mol/(L·s).V(O2):V(NO)=1:2,所以.V(O2)=1/2×V(NO)= 1/2× 0.003mol/(L·s)= 1.5×10-3
mol/(L·s).(3)A.在任何时刻都存在v(NO2)=2v(O2),所以不能作为判断平衡的标准。错误。B.由于该反应是反应前后气体体积不等的可逆反应,若反应未达到平衡,容器内的气体的物质的量就要腐蚀变化,容器内压强也要变化。若压强保持不变,则说明气体的物质的量都不变化。反应达到平衡状态。正确。C.在任何时刻的存在v正(NO)=2v正(O2);而v逆(NO)=2v正(O2)说明v正(NO)= v逆(NO)。所以反应达到平衡。正确。D.由于容器的容积不变,反应遵循质量守恒定律,所以无论反应进行到什么程度,容器内密度都始终保持不变。因此不能作为判断是否达到平衡的标准。错误。(4)A. 及时分离出NO2气体,即减小生成物的浓度,平衡正向移动,但是由于浓度减小,所以化学反应速率减慢。错误。B.适当升高温度,化学反应速率加快。但是由于该反应的正反应为放热反应。所以根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,即向逆反应方向移动。错误。C.增大O2的浓度。增大反应物的浓度,化学反应速率加快。根据平衡移动原理:增大反应物的浓度,化学平衡向正反应方向移动。正确。D.选择高效催化剂可以提高化学反应速率。但是化学平衡不发生移动。错误。
2NO2(g)中NO与NO2的关系可知b是NO2的变化的曲线。V(NO)= (0.01mol/L-0.004mol/L)÷2s=0.003mol/(L·s).V(O2):V(NO)=1:2,所以.V(O2)=1/2×V(NO)= 1/2× 0.003mol/(L·s)= 1.5×10-3
mol/(L·s).(3)A.在任何时刻都存在v(NO2)=2v(O2),所以不能作为判断平衡的标准。错误。B.由于该反应是反应前后气体体积不等的可逆反应,若反应未达到平衡,容器内的气体的物质的量就要腐蚀变化,容器内压强也要变化。若压强保持不变,则说明气体的物质的量都不变化。反应达到平衡状态。正确。C.在任何时刻的存在v正(NO)=2v正(O2);而v逆(NO)=2v正(O2)说明v正(NO)= v逆(NO)。所以反应达到平衡。正确。D.由于容器的容积不变,反应遵循质量守恒定律,所以无论反应进行到什么程度,容器内密度都始终保持不变。因此不能作为判断是否达到平衡的标准。错误。(4)A. 及时分离出NO2气体,即减小生成物的浓度,平衡正向移动,但是由于浓度减小,所以化学反应速率减慢。错误。B.适当升高温度,化学反应速率加快。但是由于该反应的正反应为放热反应。所以根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,即向逆反应方向移动。错误。C.增大O2的浓度。增大反应物的浓度,化学反应速率加快。根据平衡移动原理:增大反应物的浓度,化学平衡向正反应方向移动。正确。D.选择高效催化剂可以提高化学反应速率。但是化学平衡不发生移动。错误。
考点:考查化学平衡常数的表达式、化学反应速率的计算及外界条件对化学反应速率和化学平衡移动的影响的知识。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| n(A)/mol | 2.0 | 1.0 | 0.8 | 0.8 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| N2+3H2?2NH3 | ||||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
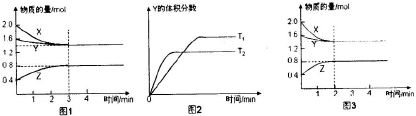
| A、反应进行的前3min内,用X表示的反应速率V(X)=0.1mol/(L?min) | B、平衡时容器内的压强为反应前的0.8倍 | C、保持其他条件不变,升高温度,反应的化学平衡常数K减小 | D、若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| n(A)/mol | 2.0 | 1.0 | 0.8 | 0.8 | 0.8 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京市门头沟区育园中学高二(下)期末化学试卷(解析版) 题型:填空题
| 时间/s | 1 | 2 | 3 | 4 | |
| n(A)/mol | 2.0 | 1.0 | 0.8 | 0.8 | 0.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com