
| n |
| V |
| 1.75g |
| 5g |
| ||
| 3 |
| 27g |
| 1.72g/mL |
| 7g |
| 74.5g/mol |
| ||
|


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:
| A、硫酸铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ |
| B、向明矾溶液中滴加Ba(OH)2溶液至Al3+刚好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
| C、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| D、稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
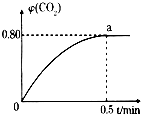 运用化学反应原理研究碳的化合物具有重要意义.
运用化学反应原理研究碳的化合物具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| △ |
| 250~350℃ |
| 铜粉 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43.其中,Y原子的最外层电子数是次外层电子数的三倍.X、Y元素的单质都是构成空气的主要成分.
有X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43.其中,Y原子的最外层电子数是次外层电子数的三倍.X、Y元素的单质都是构成空气的主要成分.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=2的盐酸和pH=12的Ba(OH)2溶液混合后:pH=7 |
| B、0.1 mol?L-1的KHA溶液,其pH=10:c(HA-)>c(OH-)>c(H+)>c(A2-) |
| C、pH=6的醋酸与醋酸钠混合溶液中,c(Na+)>c(CH3COO-) |
| D、pH相等的CH3COONa、Na2CO3、NaHCO3三种溶液:c(NaHCO3)>c(CH3COONa)>c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、①②④⑤ |
| C、②③⑤⑥ | D、③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com