
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④⑤ | C.①③⑤ | D.①③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO2增多使太阳辐射到地球表面的能量增多 |
| B.植物的光合作用吸收了CO2 |
| C.CO2能放出能量,使地球变暖 |
| D.CO2、CH4等温室气体会吸收地球表面发出的长波辐射,减少地球的热量散失 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.减少化石燃料的使用,开发新能源 |
| B.使用无氟冰箱,减少氟利昂排放 |
| C.多步行或乘公交车,少用私家车 |
| D.将工业废气用碱液吸收后再排放 |
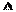 n(H+)= mol。
n(H+)= mol。 N2O4(g) △H<0的平衡常数K=13.3。
N2O4(g) △H<0的平衡常数K=13.3。 CH3OH(g),己知该反应在300OC时的化学平衡常数为0.27,该温度下将2moI CO、3mol H2利2molCH3OH(g)充入容积为2 L的密闭容器中,此时反应将 。(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
CH3OH(g),己知该反应在300OC时的化学平衡常数为0.27,该温度下将2moI CO、3mol H2利2molCH3OH(g)充入容积为2 L的密闭容器中,此时反应将 。(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由氮气为原料合成氨是氮的固定 |
| B.向煤中加入生石灰可减少对大气的污染 |
| C.氟里昂(CCl2F2)或NOX都可破坏臭氧层而导致温室效应 |
| D.HgCl2的稀溶液可用于手术器械消毒,原因是HgCl2可使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com