
【题目】下列各组离子中,每个离子都能影响水的电离平衡的是( )
A.![]()
B.![]()
C.![]()
D.![]()
【答案】C
【解析】
影响因素有温度、酸、碱、盐等,加热促进电离;加酸、加碱抑制水的电离;能水解的盐促进水的电离,结合离子的性质解答该题。
A.Cl-,SO42-为强酸的阴离子,不能结合水电离的氢离子生成弱电解质,不能影响水的电离,故A错误;
B.Br-为强酸的阴离子,不能结合水电离的氢离子生成弱电解质,不能影响水的电离,故B错误;
C.Ag+、Fe2+为弱碱阳离子,SO32-、SiO32-、S2-为弱酸的阴离子,都能与水电离出的氢离子或氢氧根离子结合成弱电解质,能促进水的电离,故C正确;
D.NO3-为强酸的阴离子,不能结合水电离的氢离子生成弱电解质,不能影响水的电离,故D错误。
故答案为D。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】有机物X和Y可作为“分子伞”给药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。
X(C24H40O5):
Y:H2NCH2CH2CH2NHCH2CH2CH2CH2NH2
下列叙述错误的是( )
A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O
B.1 mol Y发生类似酯化的反应,最多消耗2 mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y与癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述CH3—CH=CH—C≡C—CF3分子结构的下列叙述中,正确的是
A. 6个碳原子有可能都在一条直线上 B. 6个碳原子不可能都在一条直线上
C. 6个碳原子有可能都在同一平面上 D. 6个碳原子不可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)8羟基喹啉被广泛用作金属离子的络合剂和萃取剂,也是重要的医药中间体。下图是8羟基喹啉的合成路线。
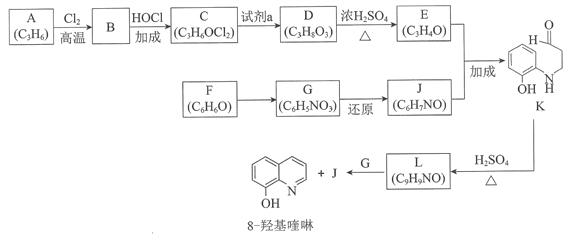
已知:i. 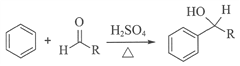
ii.同一个碳原子上连有2个羟基的分子不稳定。
(1)按官能团分类,A的类别是__________。
(2)A→B的化学方程式是____________________。
(3)C可能的结构简式是__________。
(4)C→D所需的试剂a是__________。
(5)D→E的化学方程式是__________。
(6)F→G的反应类型是__________。
(7)将下列K→L的流程图补充完整:____________
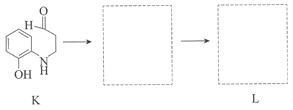
(8)合成8羟基喹啉时,L发生了__________(填“氧化”或“还原”)反应,反应时还生成了水,则L与G物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示0.2mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000mo1· L—1NaOH溶液滴定25.00mLCH3COOH的滴定曲线,则c(CH3COOH)=0.100 mo1· L—1
C. 图3表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
D. 图4表示恒温恒容条件下,2NO2(g) ![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似。下列对NCl3和NH3的有关叙述正确的是( )
A.NCl3的沸点高于NH3的沸点
B.在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3H2O分子,则NH3H2O的结构式为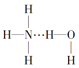
C.NCl3分子是非极性分子
D.NBr3比NCl3易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示0.001 mol·L一1盐酸滴定0.001 mol·L一1NaOH溶液的滴定曲线
B.图2所示,石墨的熔点比金刚石低
C.图3表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3
D.图4所示,图中的阴影部分面积的含义是「v(正)一v(逆)〕
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com