
一定条件下,反应室(容积恒定为2L)中有反应:A(g) +2B(g) C(g)
C(g)
(1)能说明上述反应达到平衡状态的是 (选填字母)。
A.反应中A与B的物质的量浓度之比为1︰2
B.混合气体总物质的量不再变化
C.混合气体的密度不随时间的变化而变化
D.2υ正(A)= υ逆(B)
(2)该反应平衡常数K的表达式:K= 。
(3)1molA(g)与2molB(g)在催化剂作用下在反应室反应生成C(g),A的平衡转化率与温度、压强的关系如下图所示,则:
①P1 P2 , 正反应的△H 0(填“<”、“>”或“=”)。
②下列措施中一定能使c(C)/c(A)增大的是 (选填编号)。
A.升高温度 B.恒温恒容再充入A
C.恒温恒容再充入B D.恒温恒容再充入1 mol C
(4)100℃时将1mol A和2molB通入反应室,保持温度不变,10min末C(g) 的浓度为0.05mol/L ,则10min末B转化率= ,此时υ正 υ逆
(填“<”、“>”或“=”)。
(11分)
(1)BD(2分)
(2)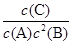 (2分)
(2分)
(3)① <(1分) <(1分) ② CD(2分)
(4)10%(2分) >(1分)
解析试题分析:⑴A.反应中A与B的物质的量浓度之比为1︰2 ,但随时间的变化,它们的物质的量浓度在变化,则不是平衡状态,A错误;B、因该反应是物质的量在减少的化学反应,则混合气体的总物质的量不随时间的变化而变化,达到平衡状态,B正确;C、混合气体的质量、体积一直不变,则密度始终不变,不能作为判断平衡的依据,C错误;D、平衡时正逆反应速率相等,由化学反应中反应速率之比等于化学计量数之比,则υ正(A): υ逆(B)=1:2,即2υ正(A)= υ逆(B),D正确,选BD。
⑵平衡常数K的表达式:K=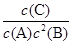 ,答案:
,答案: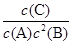 。
。
⑶①A(g) +2B(g)  C(g) 是气体体积缩小的反应,同一温度,P2时A的转化率大,压强大,P1<P2 ,压强相同时,温度升高,A的转化率降低,平衡逆向移动,正向放热,△H<0;②A、温度升高,A的转化率降低,平衡逆向移动,c(C)/c (A)减小;B、恒温恒容再充入A,平衡正向移动,c(C)/c (A)减小;C、恒温恒容再充入B ,平衡正向移动,c(C)增大,c (A)减小,c(C)/c (A)增大;D、恒温恒容再充入1 mol C,c(C)增大,c (A)增大的量少,c(C)/c (A)增大。选C D。
C(g) 是气体体积缩小的反应,同一温度,P2时A的转化率大,压强大,P1<P2 ,压强相同时,温度升高,A的转化率降低,平衡逆向移动,正向放热,△H<0;②A、温度升高,A的转化率降低,平衡逆向移动,c(C)/c (A)减小;B、恒温恒容再充入A,平衡正向移动,c(C)/c (A)减小;C、恒温恒容再充入B ,平衡正向移动,c(C)增大,c (A)减小,c(C)/c (A)增大;D、恒温恒容再充入1 mol C,c(C)增大,c (A)增大的量少,c(C)/c (A)增大。选C D。
⑷ A(g) +2B(g)  C(g)
C(g)
C始/mol/L 0.5 1
△c/mol/L 0.05 0.1 0.05
C平/mol/L 0.45 0.9 0.05
B转化率=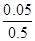 ×100%=10%,
×100%=10%,
100℃时由图,A的转化率为50%时,A、B、C各物质的浓度分别为0.025、0.05、0.025,K=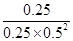 =4,Qc=
=4,Qc=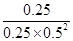 <K,平衡正向移动,此时υ正>υ逆;答案:10%,>。
<K,平衡正向移动,此时υ正>υ逆;答案:10%,>。
考点:化学平衡常数及其计算


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:填空题
在常温、常压、光照条件下,N2在催化剂表面与水发生下列反应:
2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
上述反应NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
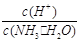 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.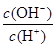
 4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
4NO(g)+6H2O(g) ΔH<0,若起始的物质的量相同,则下列关系图正确的是________(填序号):
| 时间/浓度 | c(NH3) (mol/L) | c(O2 ) (mol/L) | c(NO) (mol/L) |
| 起始 | 0.8000 | 1.600 | 0.000 |
| 第4 min | 0.3000 | 0.9750 | 0.5000 |
| 第6 min | 0.3000 | 0.9750 | 0.5000 |
| 第8 min | 0.7000 | 1.475 | 0.1000 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
反应aA+bB  cC在体积为2L的容器中进行反应。在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质的量随时间变化的曲线如下图所示:
cC在体积为2L的容器中进行反应。在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质的量随时间变化的曲线如下图所示:
请回答下列各题:
(1)反应的化学方程式为_____________________________
(2)A的平均反应速率vI(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为________________
(3)由计算可知,第Ⅰ段20分钟时,C的平均速率vI(C)=____________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,在恒容容器中,该反应的热化学方程式为:
CO(g)+2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中能说明反应达到平衡状态的是___________
| A.体系压强保持不变 |
| B.混合气体的密度保持不变 |
| C.CO与H2的浓度之比为1∶2 |
| D.单位时间内,消耗2molH2的同时消耗1mol CH3OH |
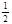 O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+
O2(g)=CO2(g) △H2=-283 kJ·mol-1 H2(g)+ 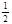 O2(g)=H2O(g) △H3=-242 kJ·mol-1
O2(g)=H2O(g) △H3=-242 kJ·mol-1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
超音速飞机在平流层飞行时,尾气中的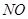 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的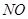 和
和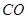 转变成
转变成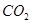 和
和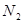 ,化学方程式:2NO+2CO
,化学方程式:2NO+2CO 2CO2+N2
2CO2+N2
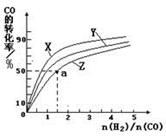
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度(mol·L-1)如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
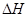 0(填写“>”、“<”、“=”)。
0(填写“>”、“<”、“=”)。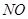 和
和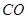 转变成
转变成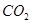 和
和 的反应速率的是 。
的反应速率的是 。| 实验编号 | T/℃ | NO初始浓度 | CO初始浓度 | 催化剂比表面积/m2·g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | | | | 124 |
| Ⅲ | 350 | | | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
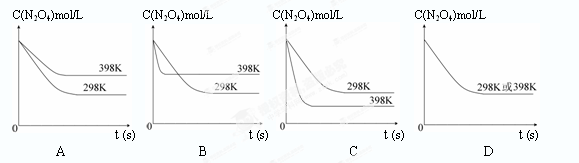
在温度为298K时,将0.10 mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g) 2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。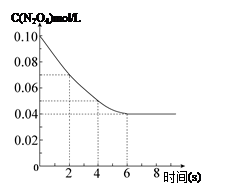
|
| T/K | 310 | 320 |
| K值 | 0.38 | 0.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定温度下的密闭容器中存在如下反应:
CO(g)+H2O(g) CO2(g)+ H2(g),已知CO(g)和H2O(g)的起始浓度均为2 mol·L-1,经测定该反应在该温度下的平衡常数K =1,试判断:
CO2(g)+ H2(g),已知CO(g)和H2O(g)的起始浓度均为2 mol·L-1,经测定该反应在该温度下的平衡常数K =1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡_______,若未达到平衡,向哪个方向进行______。
(2)达到平衡时,CO的转化率____________________。
(3)当CO的起始浓度仍为2 mol·L-1,H2O(g)的起始浓度为6 mol·L-1,求平衡时CO的转化率_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题: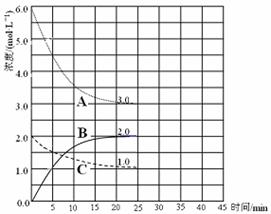
① 表示N2的浓度变化的曲线是 (选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是 。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。若升高温度,该反应的平衡常数值将___ ____(填“增大”、“减小”或“不变”)。
(3)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(4)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ______ ______。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ___ _____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)
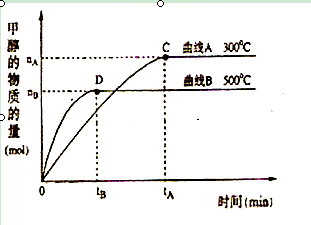
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) 。反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)常温下,某纯碱溶液中滴入酚酞,溶液呈红色。说明该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com