



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1����˹�����������Ϳ�ѧ�о����к���Ҫ�����壮��Щ��Ӧ�ķ�Ӧ����Ȼ��ֱ�Ӳ�ã�����ͨ����ӵķ����ⶨ���ָ�������3���Ȼ�ѧ��Ӧ����ʽ��
��1����˹�����������Ϳ�ѧ�о����к���Ҫ�����壮��Щ��Ӧ�ķ�Ӧ����Ȼ��ֱ�Ӳ�ã�����ͨ����ӵķ����ⶨ���ָ�������3���Ȼ�ѧ��Ӧ����ʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ɽ��ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
��1����˹�����������Ϳ�ѧ�о����к���Ҫ�����塣��Щ��Ӧ�ķ�Ӧ����Ȼ��ֱ�Ӳ�ã�����ͨ����ӵķ����ⶨ���ָ�������3���Ȼ�ѧ��Ӧ����ʽ��
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ��H����24.8kJ��mol��1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) ��H����47.4kJ��mol��1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) ��H����640.5kJ��mol��1
д��CO���廹ԭFeO����õ�Fe �����CO2������Ȼ�ѧ��Ӧ����ʽ��
��
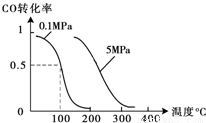
��2����ѹǿΪ0.1 MPa������,�ݻ�ΪV Lij�ܱ�������a mol CO�� 2a mol H2�ڴ��������·�Ӧ���ɼ״���CO(g)+2H2(g) 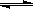 CH3OH(g)��CO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
CH3OH(g)��CO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��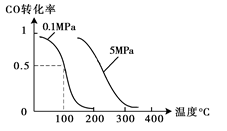
�ٸ÷�Ӧ�ġ�H 0 ���<������>����=������
�����¶��ݻ����������£�����ܱ�������
����a mol CO�� 2a mol H2���ﵽ��ƽ��ʱ��CO��ת������ �����������С�����䡱����
��3��ʵ����������AgNO3��Һʱͨ����Ҫ�����м��� ��Ŀ���� �� AgCl��ˮ�д��ڳ����ܽ�ƽ�⣺
AgCl(s) Ag+(aq)+Cl-(aq)��25oCʱ���ֽ�����AgCl�ֱ���룺��l00mL����ˮ����l0 0mL 0.2 mol?L-1AgNO3��Һ����100mL 0.1 mol?L-1�Ȼ�þ��Һ����100mL 0.1 mol?L-1�Ȼ�����Һ����ֽ������ͬ�¶���Ag+Ũ���ɴ�С��˳���� ����д��ţ���
Ag+(aq)+Cl-(aq)��25oCʱ���ֽ�����AgCl�ֱ���룺��l00mL����ˮ����l0 0mL 0.2 mol?L-1AgNO3��Һ����100mL 0.1 mol?L-1�Ȼ�þ��Һ����100mL 0.1 mol?L-1�Ȼ�����Һ����ֽ������ͬ�¶���Ag+Ũ���ɴ�С��˳���� ����д��ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��ɽ��ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��1����˹�����������Ϳ�ѧ�о����к���Ҫ�����塣��Щ��Ӧ�ķ�Ӧ����Ȼ��ֱ�Ӳ�ã�����ͨ����ӵķ����ⶨ���ָ�������3���Ȼ�ѧ��Ӧ����ʽ��
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ��H����24.8kJ��mol��1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) ��H����47.4kJ��mol��1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) ��H����640.5kJ��mol��1
д��CO���廹ԭFeO����õ�Fe �����CO2������Ȼ�ѧ��Ӧ����ʽ��
��
��2����ѹǿΪ0.1 MPa������,�ݻ�ΪV Lij�ܱ�������a mol CO�� 2a mol H2�ڴ��������·�Ӧ���ɼ״���CO(g)+2H2(g) 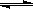 CH3OH(g)��CO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
CH3OH(g)��CO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
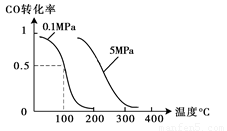
�ٸ÷�Ӧ�ġ�H 0 ���<������>����=������
�����¶��ݻ����������£�����ܱ�������
����a mol CO�� 2a mol H2���ﵽ��ƽ��ʱ��CO��ת������ �����������С�����䡱����
��3��ʵ����������AgNO3��Һʱͨ����Ҫ�����м��� ��Ŀ���� �� AgCl��ˮ�д��ڳ����ܽ�ƽ�⣺
AgCl(s) Ag+(aq)+Cl-(aq)��25oCʱ���ֽ�����AgCl�ֱ���룺��l00mL����ˮ����l0 0mL 0.2 mol?L-1AgNO3��Һ����100mL 0.1 mol?L-1�Ȼ�þ��Һ����100mL 0.1 mol?L-1�Ȼ�����Һ����ֽ������ͬ�¶���Ag+Ũ���ɴ�С��˳���� ����д��ţ���
Ag+(aq)+Cl-(aq)��25oCʱ���ֽ�����AgCl�ֱ���룺��l00mL����ˮ����l0 0mL 0.2 mol?L-1AgNO3��Һ����100mL 0.1 mol?L-1�Ȼ�þ��Һ����100mL 0.1 mol?L-1�Ȼ�����Һ����ֽ������ͬ�¶���Ag+Ũ���ɴ�С��˳���� ����д��ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ɽ��ʡ�����и߶����ϣ���ĩ��ѧ�Ծ��������棩 ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com