
����Ŀ����Ԫ���ں����е�ѭ����������������̬ϵͳ�Ļ����ؼ���������������ѭ�����̿�����ͼ��ʾ�� 
��1�������еĵ�ѭ����ʼ�ڵ��Ĺ̶����������ڹ̵����õ�һ��������ͼ��������ţ���
��2�����й��ں���ѭ����˵����ȷ����������ĸ��ţ���
a�������д�������̬�ĵ�
b�������еĵ�ѭ����ʼ�ڵ�������
c�������еķ���������һ���������IJ���
d�������ŷź�NO3���ķ�ˮ��Ӱ�캣����NH4+�ĺ���
��3������ʱ��������ϸ�������£�NH4+��ʵ�ֹ��̢ܵ�ת���������̢ܵ����ӷ���ʽ����������
NH4++5O2�T2NO2��+H+++
��4�������о����¶ȶԺ�������ϸ��ȥ������Ч����Ӱ�죬�±�Ϊ��10L�˹���ˮ�����ļ�����ݣ�
�¶�/�� | ������������/mg | ����24h | ����48h |
��������/mg | ��������/mg | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
����ϸ��ȥ����������ѷ�Ӧ�¶��� �� ����ѷ�Ӧ�¶�ʱ��48h��ȥ��������Ӧ��ƽ��������mgL��1h��1 ��
��5��Ϊ�˱��⺬����ˮ�Ժ���ѭ��ϵͳ��Ӱ�죬�辭�������ŷţ�ͼ�Ǽ��������ҵ��ˮ�а�����NH4+����ʾ��ͼ�� 
�ٽ�ϵ缫��Ӧʽ�������������ȥ��������ԭ���� ��
��������H2��N2�����ʵ���֮��Ϊ3��1���������ˮ��pH��������������䡱��С��������������ɣ� ��
���𰸡�
��1����
��2��ad
��3��6��N2O��5H2O
��4��25�棻1.125
��5��������Ӧ2Cl����2e��=Cl2 �� ������Cl2������ˮ�е�NH4+�ͷų�N2����С����·��ͨ����ͬ����ʱ��������n��H2����n��N2��=3��1��������������H+���������ĵ�H+��
���������⣺��1�����Ĺ̶�������ָ����̬��Ԫ�ط�����Ӧ���ɻ���̬��Ԫ�صĹ���Ϊ�̵����ã������ʱ仯Ϊ���������ת����ϵͼ��ֻ֪�з�Ӧ���ǵ�������Ϊ笠������ǹ̵����ã�
���Դ��ǣ��ڣ�
��2.��a�������в���������̬�ĵ�����Ԫ�����Ի���̬���ڣ���Ҫ����������ӣ���a����
b��ת����ϵͼ��֪�����еĵ�ѭ����ʼ�ڵ����������������������������Ӧ�õ�笠��������ͨ���������õõ���������ӣ���b��ȷ��
c��������������ָ��������ת��ɵ����Ĺ��̣�����������ָ������������������Ϊ����Ĺ��̣�����ϸ����������Ϊ����Ĺ��̣����������ã�������ϸ����ȱ�������£���ԭ�����Σ��ͷų�����̬����N2����һ����������N2O���Ĺ��̣���һ�������μӣ���c����
d��ת����ϵͼ��������������࣬������������ǿ�������ŷź�NO3���ķ�ˮ��Ӱ�캣����NH4+�ĺ�������d��ȷ��
���Դ��ǣ�ad��
��3.������ʱ��������ϸ�������£�NH4+��ʵ�ֹ��̢ܵ�ת��������N2O��NO2����H+��ˮ����Ԫ�ػ��ϼ۩�3�۱仯Ϊ+1�ۺ�+3�ۣ���Ԫ�ػ��ϼ�0�۱仯Ϊ��2�ۣ�����ת������20e�� �� ����笠�����ǰΪ4������ǰΪ5��NO2��ǰΪ2��N2OǰΪ1����ϵ���غ�õ�������ǰΪ6��ˮ����ʽǰΪ5����ƽ�õ����ӷ���ʽΪ��4NH4++5O2�T2NO2��+6H++N2O+5H2O��
���Դ��ǣ�6��N2O��5H2O��
��4.������ϸ��ȥ����������ѷ�Ӧ�¶��Ǵ���24h�ʹ���48h���������ٵ��¶���25��C������Ч���ã�����ѷ�Ӧ�¶�ʱ��48h��ȥ��������Ӧ��ƽ������= ![]() =1.125mg/��Lh��
=1.125mg/��Lh��
���Դ��ǣ�25�棬1.125��
��5.����װ��ͼ������֪�͵�Դ����������Ϊ��������Һ��������������ʧ���������������缫��ӦΪ��2Cl����2e��=Cl2 ������������ǿ������������Һ��������笠�����Ϊ������ȥ��
���Դ��ǣ�������Ӧ2Cl����2e��=Cl2 �� ������Cl2������ˮ�е�NH4+�ͷų�N2��
�ڵ����������缫��Ӧ�ǣ�2Cl����2e��=Cl2����3Cl2+2NH4+=N2+8H++6Cl�� �� �����缫��ӦΪ��2H++2e��=H2����������n ��H2����n ��N2��=3��1�������غ�õ�6H+��3H2��6e����N2��3Cl2��6e����8H+ �� ����������H+���������ĵ�H+�࣬ry PH��С��
���Դ��ǣ���С�����ɣ���·��ͨ����ͬ����ʱ��������n ��H2����n ��N2��=3��1��������������H+���������ĵ�H+�ࣻ


 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л��ﲻ��ͬ���칹�����(����)
A. �����Ǻ���B. ���Ǻ���ѿ��
C. ���ۺ���ά��D. ��������춡��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��˹̹����ѧ�о���Ա���Ƴ�һ�ֿ���һ��������ɳ�ŵ�ij������������ӵ�أ��ڲ���AlCl4�����л������ӹ��ɵ������Һ����ŵ繤��ԭ����ͼ��ʾ������˵������ȷ���ǣ� �� 
A.�ŵ�ʱ����Ϊ������ʯīΪ����
B.�ŵ�ʱ���л������������缫�����ƶ�
C.�ŵ�ʱ�ĸ�����ӦΪ��Al��3e��+7AlCl4���T4Al2Cl7��
D.���ʱ��������ӦΪ��Cn+AlCl4����e���TCnAlCl4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���˵������ȷ���ǣ� ��
A. ���Ӽ��������������Ӽ�ľ�������B. ��������ڻ�ѧ��
C. ȫ���ɷǽ���Ԫ����ɵĻ�����ֻ���γɹ��ۼ�D. �κ������ж����л�ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ�����ܱ�ʾ����٤��������ֵ���ǣ�������
A.1mol H+���еĵ�����
B.��״���£�22.4L�ƾ������ķ�����
C.1.6 g CH4 ���������
D.1L 1mol/L����������Һ������Na+ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ԭ�ӵ�������ag��12Cԭ�ӵ�������b g����NA��ʾ����٤��������ֵ������˵����ȷ���ǣ�������
A.����ԭ�ӵ����ԭ������Ϊ ![]()
B.m g����ԭ�ӵ����ʵ���Ϊ ![]() mol
mol
C.����ԭ�ӵ�Ħ������ΪaNAg
D.a g����ԭ�������ĵ�����Ϊ17 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����к����ۡ�NaCl��Na2SO4��CaCl2�Ļ����Һ��ѡ���ʵ����Լ��ͷ��������ᴿ��NaCl���壮��Ӧ��ʵ�������ͼ��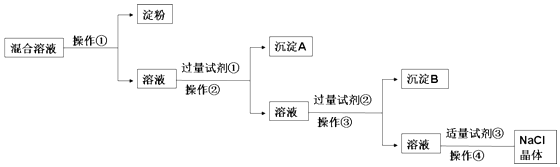
��1�������������ý��岻��ͨ�����ѵ��۽������Һ���з��룮
��2��д������ʵ������������Լ��Ļ�ѧʽ���Լ������Լ��� ��
��3���ж��Լ����ѹ����IJ����ǣ� ��
��4�������Լ��������ķ����ǣ� ��
��5���Լ��ڵ����ã��û�ѧ����ʽ��ʾ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж������������ȷ���ǣ� ��
A.��Ũ�������ǿ�����ԣ��ʲ�����������������
B.Ũ������Ũ��ˮ����ʱ������������
C.Ũ������ǿ�����ԣ�ϡ�������������
D.Ũ������и�ʴ�ԣ�ȡ��ʱҪС��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������һ�����ʵ���Ũ�ȵ�Ũ��������480mL 3.68mol/L��ϡ���
��1��������18.4mol/L��Ũ����������Һ����Ҫ�õ�Ũ��������Ϊ ��
��2�����ƹ�������Ҫ���������е�������ţ���A��������ƽB���ձ�C.100������ͲD.50������ͲE����ƿF��������G����ͷ�ι�H���Թ�I����������ƿ
��3���뽫���и�����������ȷ��������ں����ϣ�
A.����Ͳ��ȡŨH2SO4
B.��Һ��ȴ������
C.�����ߵ�ҡ��
D.�ý�ͷ�ιܼ�����ˮ���̶���
E.ϴ����Ͳ
F.ϡ��ŨH2SO4
G.����Һת������ƿ
�������ȷ��˳������Ϊ�� �� ��
��4���ý�ͷ�ι�������ƿ�м�ˮʱ����С��Һ�泬���˿̶ȣ������ķ�����
������ţ���
A.��������Һ�壬ʹ��Һ����̶�������
B.���������һ������Ũ����
C.С�ļ�������ƿ����������ʹ��Һ����̶�������
D.��������
��5����������������Ƶ�ϡ����Ũ���к�Ӱ�죿����ƫ��ƫС����Ӱ����д��
A�����õ�Ũ���᳤ʱ��������ܷⲻ�õ�������
B������ƿ������ϴ�Ӻ������������ˮ
C������ʱ����
��6��������Ͳ��ȡŨ���ᣬ��������С�ĵؼ�������ˮ��������ȣ�����ȴ�����º��ټ���ˮ���̶��ߣ��ٽ�����ȣ�����Ϊ�˷��Ƿ���ȷ��������ȷ��ָ�����д���֮�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com