
下列离子方程式书写不正确的是( )
A.向氢氧化钠溶液中通入少量的二氧化碳:CO2+OH-=HCO3-
B.单质硅与氢氟酸反应:Si+4HF=2H2↑+SiF4↑
C.石英砂与烧碱反应生成水玻璃:SiO2+2OH-=SiO32-+H2O
D.向水玻璃中通入少量二氧化碳:SiO32-+2H2O+CO2=H4SiO4↓+CO32-
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:选择题
利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是 ( )

A.a管发生吸氧腐蚀,b管发生析氢腐蚀
B.一段时间后,a管液面高于b管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:选择题
五种短周期金属元素在元素周期表中的相对位置如图所示,下列判断正确的是( )
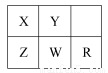
A.原子半径:Z<W<R
B.金属性:X>Z
C.氢氧化物的碱性:Z>W>R
D.最外层电子数:X>Y
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:选择题
以下说法中,不违背科学规律的是( )
①改变核外电子数可使原子与离子相互转化 ②改变核内中子数可使不同的同位素相互转化 ③改变核内质子数可使不同的元素相互转化,属于化学变化 ④改变离子的电荷数可使一种元素的阳离子转化为另一种元素的阴离子
A.①② B.②③ C.③④ D.①③
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:选择题
简单原子的原子结构可用下图形象地表示。其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的组合是 ( )
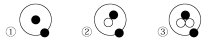
a.①②③互为同位素
b.①②③互为同素异形体
c.①②③是三种化学性质不同的粒子
d.①②③具有相同的质量数
e.①②③具有相同的质量
f.①②③是三种不同的原子
A.a、f B.b、c C.d、e D.e、f
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-3 含硅矿物与信息材料练习卷(解析版) 题型:选择题
下列表述正确的是( )
①人造刚玉的熔点很高,可用作高级耐火材料,主要成分是二氧化硅 ②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐 ③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料 ④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛 ⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
A.①②③ B.②④ C.③④⑤ D.③⑤
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-2 铁、铜的获取和应用练习卷(解析版) 题型:填空题
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:______________________________________ (列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_____________________________。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为______________________,该电池总反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-1 从铝土矿到铝合金练习卷(解析版) 题型:填空题
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
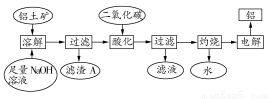
已知:
(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH
回答下列问题:
(1)写出向铝土矿中加入足量氢氧化钠溶液后,该步操作中发生反应的离子方程式: 。
(2)滤渣A的主要成分为 ;滤渣A的用途是 (只写一种);实验室过滤时使用玻璃棒,其作用是 。
(3)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是 。
(4)若将铝溶解,下列试剂中最好选用 (填编号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸
理由是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-1 氯、溴、碘及其化合物练习卷(解析版) 题型:选择题
在氯水中存在着如下反应:Cl2+H2O=HCl+HClO,因此氯水中存在多种分子和离子。在下列实验现象中与相应离子或分子性质关系正确的是( )
A.氯水有刺激性气味说明氯水中有HCl
B.氯水中滴入品红溶液,溶液为无色说明氯水中有Cl2
C.向氯水中通入SO2气体,氯水黄绿色褪去说明Cl2发生了反应
D.向氯水中加入CaCO3有气泡产生,说明有HCl和HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com