
写出计算过程
在标准状况下,体积为4.48L的CO和CO2的混合气体共7.2 g。
(1)CO的质量为________g。
(2)CO的体积为________L。
(3)混合气体的平均摩尔质量为________g·mol-1。
(4)混合气体的密度为________g·L-1。(小数点后保留1位)
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源:2016-2017学年陕西省高二上10月月考化学试卷(解析版) 题型:选择题
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的反应热ΔH=2×(-57.3) kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上10月月考化学卷(解析版) 题型:填空题
氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。

图中t1时引起平衡移动的条件可能是 ,其中表示平衡混合物中NH3的含量最高的一段时间是 ,若t0-t1,t1-t3,t3-t5这三段平衡常数分别用K1,K2,K3表示,那么K1,K2,K3的大小关系是____________。
(2)若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“ 向右”或“不”);使用催化剂反应的ΔH (填“增大”、“减小”或“不改变”)。
(3)温度为T ℃时,将2a mol H2和 a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上10月月考化学卷(解析版) 题型:选择题
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ·mol-1。
2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.容器②中达平衡时放出的热量Q=23.15 kJ
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上10月月考化学卷(解析版) 题型:选择题
S(单斜)和S(正交)是硫的两种同素异形体。
已知:①S(单斜,s)+O2(g)===SO2(g) ΔH1=-297.16 kJ·mol-1
②S(正交,s)+O2(g)===SO2(g) ΔH2=-296.83 kJ·mol-1
③S(单斜,s)===S(正交,s) ΔH3
下列说法正确的是
A.ΔH3=+0.33 kJ·mol-1
B.单斜硫转化为正交硫的反应是吸热反应
C.S(单斜,s)===S(正交,s) ΔH3<0,正交硫比单斜硫稳定
D.S(单斜,s)===S(正交,s) ΔH3>0,单斜硫比正交硫稳定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一上9月月考化学卷(解析版) 题型:选择题
同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是( )
A.密度比为16:11 B.分子个数比为16:11
C.体积比为1:1 D.氧原子个数比为1:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一上9月月考化学卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,18 g H2O中含有的电子总数为10NA
B.1 mol·L-1 NaCl溶液含有NA个Na+
C.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为3 NA
D.标准状况下,2.24LCH4所含中子数为NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上9月月考化学卷(解析版) 题型:填空题
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
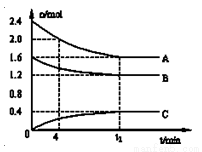
1)写出该反应的方程式:__________________
2)计算该温度下该反应的平衡常数:____________
3)已知:K(300℃)<K(350℃),该反应是__________热反应.
4)0~4分钟时,B的平均反应速率为:____________
5)到达平衡时A的转化率为:____________
6)恒容条件下,下列措施中能使n(A)/n(C)降低的有____________.
A.充入氦气 B.使用催化剂
C.再充入2.4molA和1.6molB D.降低温度.
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第一次月考化学试卷(解析版) 题型:选择题
在不同温度下,水溶液中c(H+)与c(OH-) 有如图所示关系。下列条件关于离子共存说法中正确的是

A.a点对应的无色溶液中能大量存在:Fe3+、Na+、Cl-、SO42-
B..b点对应的溶液中能大量存在:NH4+、Ca2+、AlO2-、I-
C.c点对应的溶液中能大量存在:Na+、Ba2+、Cl-、CO32-
D.d点对应的溶液中能大量存在:Na+、K+、SO32-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com